题目内容
 化学兴趣小组的同学对碳及碳的氧化物进行了一系列拓展性探究学习.
化学兴趣小组的同学对碳及碳的氧化物进行了一系列拓展性探究学习.【探究一】二氧化碳的性质的拓展探究
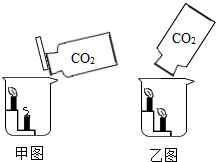
(1)倾倒二氧化碳实验
甲、乙两同学将两瓶完全相同的足够的二氧化碳气体,分别以甲图、乙图的方式将二氧化碳气体慢慢倒入烧杯中,请分析回答:
①甲同学用甲图的方式倾倒,观察到两根蜡烛是由下而上熄灭,该实验说明二氧化碳具有
既不能燃烧也不能支持燃烧
既不能燃烧也不能支持燃烧
、密度比空气大
密度比空气大
的性质. ②乙同学用乙图的方式倾倒,观察到的结果是两根蜡烛都没有熄灭,请你联系学科知识分析,蜡烛没有熄灭的原因
二氧化碳受热后密度变得比空气小,随着热气流上升,因此二氧化碳没有进入烧杯
二氧化碳受热后密度变得比空气小,随着热气流上升,因此二氧化碳没有进入烧杯
.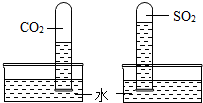
(2)二氧化碳与二氧化硫溶解性对比实验
丙同学用相同的试管分别收集了二氧化碳和二氧化硫,做了如右图所示的对比实验,现象如图.分析该现象得到的结论是
二氧化硫在水中的溶解能力大于二氧化碳
二氧化硫在水中的溶解能力大于二氧化碳
.该实验设计的思路:一是利用对比实验,二是利用气体溶于水使试管内压强减小
气体溶于水使试管内压强减小
的原理产生实验现象.【探究二】在学习了木炭还原氧化铜的实验后,小明对课本上实验进行如下改进:
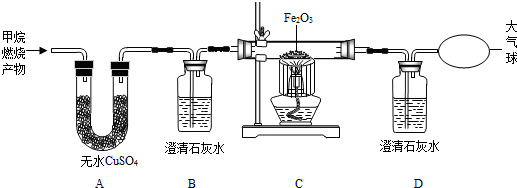
将CuO和足量炭粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水,按图连接仪器(加热装置和固定装置省略,下同).
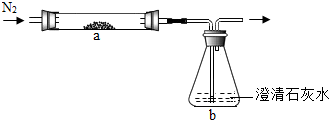
实验开始时缓慢通入氮气,过一段时间后,加热反应管a,观察到管内有红色固体产生,b瓶的溶液中出现白色浑浊.待反应完全后,停止加热,仍继续通氮气,直至反应管冷却.根据以上叙述回答问题:
(1)通N2的目的是
将反应管内的空气(或O2)排尽
将反应管内的空气(或O2)排尽
.(2)写出b瓶中发生反应的化学方程式
CO2+Ca(OH)2═CaCO3↓+H2O
CO2+Ca(OH)2═CaCO3↓+H2O
.(3)停止加热前是否需要先断开a和b的连接处?
不需要
不需要
.为什么?因为继续通入氮气,b瓶中的液体不会倒吸入a管
因为继续通入氮气,b瓶中的液体不会倒吸入a管
.(4)小梅认为:木炭与氧化铜反应产生的气体中既有CO2,又有CO.为验证此猜想,小梅对上述装置做了如下改进并实验:
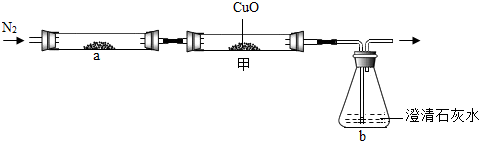
小梅观察到
甲中有红色固体生成
甲中有红色固体生成
现象,证明了气体中的确含有CO.小明认为小梅的实验不能证明木炭与氧化铜反应产生了CO2,其理由是
因为甲中CO与CuO反应生成了CO2也使澄清石灰水变浑浊,因此不能证明木炭与氧化铜反应生成了CO2
因为甲中CO与CuO反应生成了CO2也使澄清石灰水变浑浊,因此不能证明木炭与氧化铜反应生成了CO2
.(5)本实验的尾气是否需处理?如需处理,请回答如何处理;如不需处理,请说明理由:需要,因为反应过程中有CO产生,可在尾气管口放上一个点燃的酒精灯
需要,因为反应过程中有CO产生,可在尾气管口放上一个点燃的酒精灯
.分析:【探究一】(1)①要从蜡烛熄灭和从下往上熄灭来分析出二氧化碳的性质再考虑得出的结论;②没有熄灭说明二氧化碳没有进入烧杯内,再考虑二氧化碳受热后密度变化问题;(2)通过进入试管内水的多少来考虑二氧化碳和二氧化硫溶解性大小问题;
【探究二】(1)根据通入氮气的作用考虑(2)根据方程式的写法考虑:一写二配三注明;
(3)根据该实验的实验步骤中的注意事项考虑:实验完毕不能立即停止通氮气的理由考虑;
(4)根据一氧化碳的性质考虑一氧化碳的检验,一氧化碳还原氧化铜能生成铜和二氧化碳,根据实验现象来分析;
(5)根据实验后的尾气中含有大量的一氧化碳,并且一氧化碳属于有毒气体能污染空气考虑本题.
【探究二】(1)根据通入氮气的作用考虑(2)根据方程式的写法考虑:一写二配三注明;
(3)根据该实验的实验步骤中的注意事项考虑:实验完毕不能立即停止通氮气的理由考虑;
(4)根据一氧化碳的性质考虑一氧化碳的检验,一氧化碳还原氧化铜能生成铜和二氧化碳,根据实验现象来分析;
(5)根据实验后的尾气中含有大量的一氧化碳,并且一氧化碳属于有毒气体能污染空气考虑本题.
解答:解:【探究一】(1)①由两根蜡烛都熄灭可知二氧化碳既不能燃烧也不支持燃烧,由两根蜡烛是由下而上熄灭说明二氧化碳先聚集在下边,所以二氧化碳密度比空气大;
②由于蜡烛燃烧放出大量的热,二氧化碳受热后密度变得比空气小,随着热气流上升,因此二氧化碳没有进入烧杯,所以不能熄灭;
(2)通过实验现象可知盛二氧化硫的试管内进入的水多,也就是说二氧化硫要比二氧化碳在水中溶解得多;试管内能进入水说明气体溶于水后使试管内压强减小,在外界大气压的作用下,水进入试管内;
【探究二】(1)实验前通N2的目的是排净装置内空气防止爆炸;
(2)反应物是二氧化碳和氢氧化钙,生成物是碳酸钙和水,碳酸钙后面标上下降符号;
(3)碳与氧化铜反应完毕后不能立即停止通氮气,因为停止通氮气后会进入空气,生成的铜又被氧气氧化为氧化铜;只要通着氮气,液体就不会倒吸;
(4)由于一氧化碳具有还原性,能还原氧化铜,使黑色固体变为红色,所以通过灼热的氧化铜来检验是否存在一氧化碳;所以通过黑色固体变为红色来判断含有一氧化碳;
甲装置位于碳与氧化铜反应装置的后面,且甲中CO与CuO反应生成了CO2也使澄清石灰水变浑浊,因此不能证明木炭与氧化铜反应生成了CO2;
(5)由于尾气中含有大量的一氧化碳,一氧化碳有毒能污染空气,所以要进行尾气处理,用酒精灯点燃即可.
故答案为:
【探究一】(1)①既不能燃烧也不能支持燃烧;密度比空气大;(2)二氧化硫在水中的溶解能力大于二氧化碳;气体溶于水使试管内压强减小;
【探究二】(1)将反应管内的空气(或O2)排尽;(2)CO2+Ca(OH)2═CaCO3↓+H2O;(3)不需要;因为继续通入氮气,b瓶中的液体不会倒吸入a管;(4)甲中有红色固体生成;因为甲中CO与CuO反应生成了CO2也使澄清石灰水变浑浊,因此不能证明木炭与氧化铜反应生成了CO2;需要,因为反应过程中有CO产生,可在尾气管口放上一个点燃的酒精灯.
②由于蜡烛燃烧放出大量的热,二氧化碳受热后密度变得比空气小,随着热气流上升,因此二氧化碳没有进入烧杯,所以不能熄灭;
(2)通过实验现象可知盛二氧化硫的试管内进入的水多,也就是说二氧化硫要比二氧化碳在水中溶解得多;试管内能进入水说明气体溶于水后使试管内压强减小,在外界大气压的作用下,水进入试管内;
【探究二】(1)实验前通N2的目的是排净装置内空气防止爆炸;
(2)反应物是二氧化碳和氢氧化钙,生成物是碳酸钙和水,碳酸钙后面标上下降符号;
(3)碳与氧化铜反应完毕后不能立即停止通氮气,因为停止通氮气后会进入空气,生成的铜又被氧气氧化为氧化铜;只要通着氮气,液体就不会倒吸;
(4)由于一氧化碳具有还原性,能还原氧化铜,使黑色固体变为红色,所以通过灼热的氧化铜来检验是否存在一氧化碳;所以通过黑色固体变为红色来判断含有一氧化碳;
甲装置位于碳与氧化铜反应装置的后面,且甲中CO与CuO反应生成了CO2也使澄清石灰水变浑浊,因此不能证明木炭与氧化铜反应生成了CO2;
(5)由于尾气中含有大量的一氧化碳,一氧化碳有毒能污染空气,所以要进行尾气处理,用酒精灯点燃即可.
故答案为:
【探究一】(1)①既不能燃烧也不能支持燃烧;密度比空气大;(2)二氧化硫在水中的溶解能力大于二氧化碳;气体溶于水使试管内压强减小;
【探究二】(1)将反应管内的空气(或O2)排尽;(2)CO2+Ca(OH)2═CaCO3↓+H2O;(3)不需要;因为继续通入氮气,b瓶中的液体不会倒吸入a管;(4)甲中有红色固体生成;因为甲中CO与CuO反应生成了CO2也使澄清石灰水变浑浊,因此不能证明木炭与氧化铜反应生成了CO2;需要,因为反应过程中有CO产生,可在尾气管口放上一个点燃的酒精灯.
点评:通过回答本题知道了二氧化碳的性质的验证方法,一氧化碳的验证方法,了解了二氧化碳使澄清石灰水变浑浊的特性,利用一氧化碳的还原性来考虑验证方法.

练习册系列答案
相关题目


 (2012?防城港)某校化学兴趣小组的同学对学校附近小河的水质状况进行了相关的调查研究.
(2012?防城港)某校化学兴趣小组的同学对学校附近小河的水质状况进行了相关的调查研究.