摘要:(1)I2.Cl2+2I-=2Cl-+I2 (2)ClO-+2I-+H20=Cl-+2OH-+I2 (3)2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑ (4)BH4-+2H2O=BO2-+4H2↑
网址:http://m.1010jiajiao.com/timu3_id_60900[举报]
碘是人体必须的元素之一,海洋植物如海带、海藻中含有丰富的、以碘离子形式存在的碘元素.在实验室中,从海藻里提取碘的流程和实验装置如图1:

(1)指出上述提取碘的过程中有关实验操作的名称:步骤③
(2)写出步骤④对应反应的离子方程式:
(3)提取碘的过程中,可供选择的有机试剂是
A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出图2实验装置中存在的错误之处:
查看习题详情和答案>>

(1)指出上述提取碘的过程中有关实验操作的名称:步骤③
过滤
过滤
,步骤⑤萃取
萃取
.(2)写出步骤④对应反应的离子方程式:
Cl2+2I-═I2+2Cl-
Cl2+2I-═I2+2Cl-
.(3)提取碘的过程中,可供选择的有机试剂是
CD
CD
(填编号)A.酒精 B.醋酸 C.四氯化碳 D.苯
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需要经过蒸馏.指出图2实验装置中存在的错误之处:
温度计水银球的位置错误,应与蒸馏烧瓶的支管口相平
温度计水银球的位置错误,应与蒸馏烧瓶的支管口相平
.用如图所示装置可以完成一系列实验(图中夹持装置已略去)

请回答下列问题:
Ⅰ.(1)仪器p的名称是
(2)写出③中反应的离子方程式:
Ⅱ.若用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.
(1)仪器p中盛装试剂的化学式为
(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
①处包有的某固体物质可能是(填序号)
a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到
(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO-3,写出该反应的离子方程式:
查看习题详情和答案>>

请回答下列问题:
Ⅰ.(1)仪器p的名称是
分液漏斗
分液漏斗
,若用装置A由浓硫酸和亚硫酸钠固体制取SO2气体,并通过装置B完成表中设计实验,请填写表中空白:| B中棉花的位置 | ① | ② | ③ | ④ |
| 所蘸试剂 | 石蕊试液 | 品红溶液 | 淀粉和碘水混合液 | 氢硫酸 |
| 现象 | 变红 变红 |
褪色 褪色 |
褪色 | 浅黄色 |
| 体现SO2的性质 | 水溶液显酸性 | 漂白性 | 还原性 还原性 |
氧化性 |
I2+SO2+2H2O═4H++SO2-4+2I-
I2+SO2+2H2O═4H++SO2-4+2I-
.Ⅱ.若用装置A由浓硫酸和浓盐酸混合制取HCl气体,装置B中的四处棉花依次做了如下处理:①包有某固体物质、②蘸有KI溶液、③蘸有石蕊溶液、④蘸有浓NaOH溶液.
(1)仪器p中盛装试剂的化学式为
浓H2SO4
浓H2SO4
.(2)反应开始后,观察到②处有棕黄色物质产生,写出②处发生反应的离子方程式:
Cl2+2I-═I2+2Cl-
Cl2+2I-═I2+2Cl-
.①处包有的某固体物质可能是(填序号)
b
b
.a.MnO2 b.KMnO4 c.KCl d.Cu
(3)在实验过程中,在③处能观察到
先由紫色变红色,后褪色
先由紫色变红色,后褪色
.(4)反应较长时间后,②处有棕黄色褪去,生成无色的IO-3,写出该反应的离子方程式:
5Cl2+I2+6H2O═10Cl-+2IO-3+12H+
5Cl2+I2+6H2O═10Cl-+2IO-3+12H+
.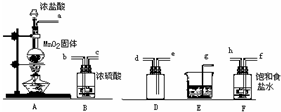 实验室用下列仪器和药品制取并收集干燥纯净的氯气.
实验室用下列仪器和药品制取并收集干燥纯净的氯气.(1)按气流从左到右,装置正确的连接是:a接
f
f
、h
h
接b
b
、c
c
接e
e
、d
d
接g
g
(填各接口字母)(2)装置F的作用是
除去混在氯气中的氯化氢
除去混在氯气中的氯化氢
,装置E的作用是吸收多余的氯气防止污染环境
吸收多余的氯气防止污染环境
.(3)装置A和E中的反应化学方程式为:A
MnO2+4HCl
MnCl2+Cl2↑+2H2O
| ||
MnO2+4HCl
MnCl2+Cl2↑+2H2O
,E
| ||
Cl2+2NaOH=NaCl+NaClO+H2O
Cl2+2NaOH=NaCl+NaClO+H2O
.(4)若A中有4.48L氯气产生(标准状态下),则参加反应的HCl有
29.2
29.2
g.(5)若将产生的氯气通入KI淀粉溶液中能观察到
溶液变为蓝色
溶液变为蓝色
,反应的离子方程式为Cl2+2I-=I2+2Cl-
Cl2+2I-=I2+2Cl-
.(2009?合肥三模)某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S,设计了以下实验流程图:

请回答下列问题:
(1)写出步骤①中发生反应的化学方程式
(2)为验证气体A中所含的成份,按如图所示进行实验,用于检验A的溶液X是
(3)有学生提出检验火柴头有KClO3的某套实验方案:

有关的离子方程式为
(4)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验.
请分析上表数据,可得出什么结论?
查看习题详情和答案>>

请回答下列问题:
(1)写出步骤①中发生反应的化学方程式
2KClO3
2KCl+3O2↑;S+O2
SO2
| ||
| △ |
| ||
2KClO3
2KCl+3O2↑;S+O2
SO2
.
| ||
| △ |
| ||
(2)为验证气体A中所含的成份,按如图所示进行实验,用于检验A的溶液X是
紫红色的KMnO4溶液
紫红色的KMnO4溶液
,若观察到褪色
褪色
现象,即可证明火柴头上含有S.(3)有学生提出检验火柴头有KClO3的某套实验方案:

有关的离子方程式为
ClO3-+5Cl-+6H+═3Cl2↑+3H2O
ClO3-+5Cl-+6H+═3Cl2↑+3H2O
,Cl2+2I-═I2+2Cl-
Cl2+2I-═I2+2Cl-
.有人提出上述方法中出现的现象并不能充分说明火柴头上有KClO3的存在,其理由是MnO2与浓盐酸共热也可产生氯气
MnO2与浓盐酸共热也可产生氯气
.(4)该小组猜测滤渣D对双氧水分解制氧气的速率会产生一定的影响,设计并进行了以下5次实验.
| 实验序号 | H2O2溶液 质量分数% |
H2O2溶液 用量/毫升 |
物质D用量(g) | 反应温度(℃) | 收集气体 体积/毫升 |
所需时间(秒) |
| ① | 30 | 5 | 0 | 85 | 2 | 3.8 |
| ② | 15 | 2 | 0.1 | 20 | 2 | 2.8 |
| ③ | 15 | 2 | 0.2 | 20 | 2 | 2.2 |
| ④ | 5 | 2 | 0.1 | 20 | 2 | 7.4 |
| ⑤ | 30 | 5 | 0 | 55 | 2 | 10.5 |
实验①和⑤能证明温度越高反应速率越快,实验②和③能证明D的用量越大反应速率越快,实验②和④证明H2O2的质量分数越大反应速率越快
实验①和⑤能证明温度越高反应速率越快,实验②和③能证明D的用量越大反应速率越快,实验②和④证明H2O2的质量分数越大反应速率越快
.化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分.利用已学知识对下列实验进行分析并填空:
Ⅰ.
Ⅱ.
Ⅲ.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为
查看习题详情和答案>>
Ⅰ.
| 实验目的 | 探究温度对H2O2分解反应速率的影响 探究温度对H2O2分解反应速率的影响 | ||||||||||
实验 |
 |
 |
 | ||||||||
| 实验结论 | 结论: 温度越高,反应速率越快 温度越高,反应速率越快 FeCl3在实验中的作用为: 催化剂 催化剂 | ||||||||||
| 反应方程式 | 2H2O2
2H2O2
| ||||||||||
| 实验目的 | 探究卤素单质氧化性的相对强弱 | |
| 实验 | 现象 | 离子方程式 |
| 1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4,振荡、静置 |
(1)溶液分层,上层几 乎无色,下层为橙色. (2) 溶液分层,上层几乎无色,下层为紫(红)色 溶液分层,上层几乎无色,下层为紫(红)色 |
(1) Cl2+2Br-=Br2+2Cl- Cl2+2Br-=Br2+2Cl- (2) Cl2+2I-=I2+2Cl- Cl2+2I-=I2+2Cl- |
| 2.将少量溴水加入盛有NaI溶液的试管中, 振荡后加入少量CCl4,振荡、静置 |
/ | (3) Br2+2I-=I2+2Br- Br2+2I-=I2+2Br- |
| 实验结论并从原子结构上解释原因 | 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 结论:氧化性:Cl2>Br2>I2 解释原因:同主族元素从上到下,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大,原子核对外层电子的引力逐渐减弱,单质的氧化性逐渐减弱 | |
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:

阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.

(2)为了证明甲图中溶液D中几乎不存在Br-,可选用的试剂为
C
C
(填选项字母).A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为
D
D
.A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
内外气压相通,使分液漏斗内液体能够顺利流下
内外气压相通,使分液漏斗内液体能够顺利流下
.(5)试计算原固体混合物中氯化钠的质量分数为
90
90
%.