网址:http://m.1010jiajiao.com/timu3_id_60787[举报]
(1)化合物C2B2的电子式为


(2)B、D分别与A形成的结构相似的两种化合物的沸点高低为
(3)已知lgA与E的单质反应时放出92.3kJ热量,写出该反应的热化学方程式
(4)B、C、D可以形成一种常见化合物M,M的水溶液呈碱性的原因是
(5)以上元素能形成的具有漂白性的化合物有
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置 。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示)
;这种化合物水溶液的pH比A2BD3水溶液的pH (填“大”或“小”),用文字简要说明原因 。
(3)A、B元素还可以形成化合物A2B2,请根据同族元素及其他合物组成和结构相似则性质相似的特点,推测并写出A2B2与稀盐酸反应的化学方程式 (用元素符号表示)。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1
2BO2(s)+O2(g) ![]() 2BO3(g);△H=-196.6kJ?mol-1
2BO3(g);△H=-196.6kJ?mol-1
则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
查看习题详情和答案>>已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
(3)已知常温条件下,极性分子DOE2是一种液态化合物,中心原子D的杂化方式是 。向盛有10mL水的锥形瓶中滴加少量的DOE2溶液,生成两种有刺激性气味的气体。请书写此反应的化学方程式 。
(4)G与氮原子可1:1化合,形成人工合成的新型半导体材料,其晶体结构与单晶硅相似。G原子的价电子排布式为 。在该合成材料中,与同一个G原子相连的N原子构成的空间构型为正四面体。在四种基本晶体类型中,此晶体属于 晶体。
(5)F晶体的堆积方式是 (填堆积名称),其配位数为 。 向F的硫酸盐溶液中滴加氨水直至过量,写出此过程所涉及的两个离子方程式 根据价层电子对互斥理论,预测SO42-的空间构型为 。 查看习题详情和答案>>
已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示:
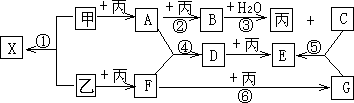
(1)写出X的电子式________;以上物质中具有漂白作用的有(填写化学式)________、________;
(2)以上①②③④⑤⑥的六个转化中,属于化合反应,但不属于氧化还原反应的是(填写编号)________;
(3)写出D→E的化学方程式:________;
(4)同类物质的化学性质具有相似性,也有特殊性.请写出物质B与F反应的可能的化学方程式:________,你这样书写的理由是:_________________________.
(1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中, 有4mol HCl被氧化时,放出120kJ的热量,且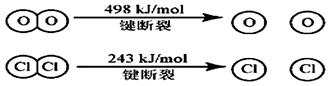
则断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差为__________KJ。
(2)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
(3)已知AlCl3熔点190℃,沸点183℃,结构如右图所示:AlCl3晶体内含有的作用力有 (填序号)。
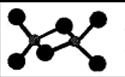
A.离子键 B.共价键 C.金属键
D.配位键 E.范德华力 F. 氢键
(4)氯和钾与不同价态的铜可生成两种化合物,这两种化合物中的阴离子均为无限长链结构(如下图),a位置上Cl原子的杂化轨道类型为 ,已知其中一种化合物的化学式为KCuCl3,另一种的化学式为 。
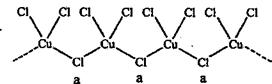 查看习题详情和答案>>
查看习题详情和答案>>