摘要:答:(1)主要包含了水的蒸发和大气中水蒸气液化两种物态变化. (2)方法一:蒸发结晶的方法.若有较多晶体析出的是咸水.反之是淡水. 方法二:测导电性的方法.若有较强的导电性的是咸水.反之是淡水. 方法三:用AgNO3和稀HNO3检验是否有Cl-的方法. 若明显有不溶于稀硝酸的白色沉淀生成的是咸水.反之是淡水.
网址:http://m.1010jiajiao.com/timu3_id_6070[举报]
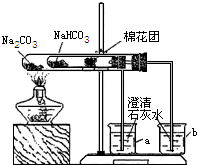 某校同学对市场上的食品疏松剂进行了如下探究.
某校同学对市场上的食品疏松剂进行了如下探究.实验一:甲小组的同学收集到一包主要成分是小苏打(碳酸氢钠)的疏松剂
(1)取样品溶于适量的水中,测得溶液的pH大于7.
(2)向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳.该反应的化学方程式为
(3)同学们通过查阅资料,在老师的指导下采用了如图所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,
b烧杯中石灰水了现白色浑浊.试回答:①在实验结束时,操作上要注意的问题是:
②由实验(3)可以得出的结论是
实验二:乙小组的同学收集到一包名为“臭粉”的疏松剂,为探究其组成,进行实验:
(1)“臭粉”为一种白色固体,易溶于水;
(2)取少量样品与稀盐酸混合后产生了可以使石灰水变混浊的气体;
(3)取少量样品加热后,产生了有刺激性气味的气体;
(4)少量样品与氢氧化钠溶液混合后共热,产生了使湿润的红色石蕊试纸变蓝的臭气.
调查后得知,“臭粉”的主要成分是初中化学课本中一种常见的盐.
①你认为该盐是
②用“臭粉”作疏松剂的油炸食品放置后再销售和食用的原因可能是
③某些小商贩喜欢选用“臭粉”代替“小苏打”作疏松剂的原因可能是
实验三:丙小组同学探究小苏打、“臭粉”在制作食品过程中产生气泡的原因
(1)两种疏松剂产生的气体中都含有
(2)小组的同学将少许面粉加入水中取上层液体用pH试纸测得:pH=7.猜测产生气体的原因是
实验四:丁小组的同学在某超市发现一种复合疏松剂--发酵粉,其成分见表:
| 成分 | 所用物质 |
| 碳酸盐类 | 碳酸氢钠 |
| 酸性物质 | 柠檬酸、酒石酸等 |
| 疏松剂 | 明矾 |
| 其他成分 | 淀粉、脂肪酸等 |
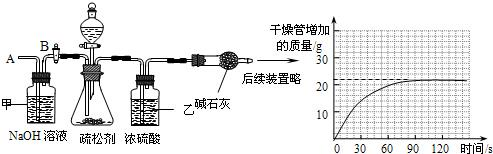
(2)为测定其中碳酸氢钠的质量分数,小组的同学设计了如下实验,其主要实验步骤如下:
Ⅰ.按图组装仪器,将50.0g试样放入锥形瓶中,加入足量某酸溶液;
Ⅱ.测量一定时间内干燥管内物质增加的质量(见下列曲线);
Ⅲ.待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
Ⅳ.再次称量干燥管内物质增加的质量;
Ⅴ.重复Ⅲ和Ⅳ的操作,直至干燥管内物质质量不变.
讨论:
①步骤Ⅰ.加入样品前还应检查
②装置乙的作用是
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程,本小题4分) 查看习题详情和答案>>
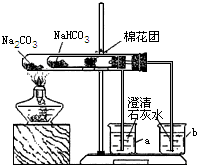 某校同学对市场上的食品疏松剂进行了如下探究.
某校同学对市场上的食品疏松剂进行了如下探究.
实验一:甲小组的同学收集到一包主要成分是小苏打(碳酸氢钠)的疏松剂
(1)取样品溶于适量的水中,测得溶液的pH大于7.
(2)向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳.该反应的化学方程式为________.
(3)同学们通过查阅资料,在老师的指导下采用了如图所示装置用小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,
b烧杯中石灰水了现白色浑浊.试回答:①在实验结束时,操作上要注意的问题是:________
②由实验(3)可以得出的结论是________.北方农村地区用“碱面”(碳酸钠)蒸馒头时,必须先将面粉发酵(产生一些有机酸)的原因是________.
实验二:乙小组的同学收集到一包名为“臭粉”的疏松剂,为探究其组成,进行实验:
(1)“臭粉”为一种白色固体,易溶于水;
(2)取少量样品与稀盐酸混合后产生了可以使石灰水变混浊的气体;
(3)取少量样品加热后,产生了有刺激性气味的气体;
(4)少量样品与氢氧化钠溶液混合后共热,产生了使湿润的红色石蕊试纸变蓝的臭气.
调查后得知,“臭粉”的主要成分是初中化学课本中一种常见的盐.
①你认为该盐是________,它加热后反应的方程式为________
②用“臭粉”作疏松剂的油炸食品放置后再销售和食用的原因可能是________.
③某些小商贩喜欢选用“臭粉”代替“小苏打”作疏松剂的原因可能是________.
实验三:丙小组同学探究小苏打、“臭粉”在制作食品过程中产生气泡的原因
(1)两种疏松剂产生的气体中都含有________.推测产生这种气体的原因有________;________.
(2)小组的同学将少许面粉加入水中取上层液体用pH试纸测得:pH=7.猜测产生气体的原因是________.
实验四:丁小组的同学在某超市发现一种复合疏松剂--发酵粉,其成分见表:
| 成分 | 所用物质 |
| 碳酸盐类 | 碳酸氢钠 |
| 酸性物质 | 柠檬酸、酒石酸等 |
| 疏松剂 | 明矾 |
| 其他成分 | 淀粉、脂肪酸等 |
(2)为测定其中碳酸氢钠的质量分数,小组的同学设计了如下实验,其主要实验步骤如下:
Ⅰ.按图组装仪器,将50.0g试样放入锥形瓶中,加入足量某酸溶液;
Ⅱ.测量一定时间内干燥管内物质增加的质量(见下列曲线);
Ⅲ.待锥形瓶中不再产生气泡时,打开活塞B,从导管A处缓缓鼓入一定量的空气;
Ⅳ.再次称量干燥管内物质增加的质量;
Ⅴ.重复Ⅲ和Ⅳ的操作,直至干燥管内物质质量不变.

讨论:
①步骤Ⅰ.加入样品前还应检查________,所加的酸溶液是________.
②装置乙的作用是________;从导管A处缓缓鼓入一定量的空气时,装置甲的作用是________.
③请利用有关数据计算试样中碳酸氢钠的质量分数.(写出计算过程,本小题4分) 查看习题详情和答案>>
化学教师在课堂上做了一个小魔术:吹气生火.只见老师通过一根细长的玻璃管,对着蒸发皿中的一团棉花吹气,不一会,棉花就燃烧起来.同学们觉得很好奇:通常情况下,嘴中呼出的气体是不会使棉花燃烧的.为什么老师对着棉花吹气就能使其燃烧?
同学们已经知道:可燃物的燃烧需要两个条件①______②______;
小娟同学课下询问老师知道了其中的道理:口中吹出的气体中含有一定量的CO2,棉花(实为脱脂棉)中包裹着黄色过氧化钠(Na2O2),CO2与Na2O2反应生成白色的Na2CO3和氧气,同时放出大量的热,最终使棉花燃烧起来.请帮助小娟同学完成下列问题:
(1)写出Na2O2与CO2反应的化学方程式:______.
(2)小娟同学通过查阅资料得知:
①Na2O2不仅能与CO2反应也能够与H2O反应.
②碱石灰中的成分既能吸收水蒸气,又能吸收二氧化碳.
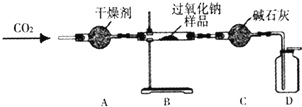
她设计了如图所示装置,来验证Na2O2与CO2反应生成了O2,并测定某过氧化钠样品中Na2O2的质量分数(杂志不参加反应).
实验步骤如下:①连接装置并检查气密性;
②向A-C装置中加入相应的药品,其中B装置内加入过氧化拿样品的质量为9.0g;
③缓慢通入CO2,充分反应后,称得B装置中固体药品的质量为11.8g.
回答下列问题:
a.检验D装置中收集到的气体是氧气的操作是______.
b.A装置的主要作用是______.装置A中干燥及能否使用碱石灰?______(填“能”或“不能”),原因是______
c.装置c的作用是______
d.实验测得该过氧化钠样品中Na2O2的质量分数为______.(精确到0.1%)
查看习题详情和答案>>
同学们已经知道:可燃物的燃烧需要两个条件①______②______;
小娟同学课下询问老师知道了其中的道理:口中吹出的气体中含有一定量的CO2,棉花(实为脱脂棉)中包裹着黄色过氧化钠(Na2O2),CO2与Na2O2反应生成白色的Na2CO3和氧气,同时放出大量的热,最终使棉花燃烧起来.请帮助小娟同学完成下列问题:
(1)写出Na2O2与CO2反应的化学方程式:______.
(2)小娟同学通过查阅资料得知:
①Na2O2不仅能与CO2反应也能够与H2O反应.
②碱石灰中的成分既能吸收水蒸气,又能吸收二氧化碳.
她设计了如图所示装置,来验证Na2O2与CO2反应生成了O2,并测定某过氧化钠样品中Na2O2的质量分数(杂志不参加反应).
实验步骤如下:①连接装置并检查气密性;
②向A-C装置中加入相应的药品,其中B装置内加入过氧化拿样品的质量为9.0g;
③缓慢通入CO2,充分反应后,称得B装置中固体药品的质量为11.8g.
回答下列问题:
a.检验D装置中收集到的气体是氧气的操作是______.
b.A装置的主要作用是______.装置A中干燥及能否使用碱石灰?______(填“能”或“不能”),原因是______
c.装置c的作用是______
d.实验测得该过氧化钠样品中Na2O2的质量分数为______.(精确到0.1%)

兴化地处里下河地区,河港纵横,水系发达.但河水中含有较多的碳酸氢钙[Ca(HCO3)2],水的硬度较大.(查阅资料:碳酸氢钙易溶于水.当溶有碳酸氢钙的水遇热时,溶解在水里的碳酸氢钙就会发生分解,生成碳酸钙沉积下来,这就形成了水垢Ca(HCO3)2△CaCO3↓+H2O+CO2↑).已知碳酸氢钠、碳酸氢钾、碳酸氢镁等物质均能在加热条件下发生类似的反应.而碳酸钠、碳酸钾则在通常情况下比较稳定,加热不分解.
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是 .你能用什么方法来除去水垢?(用化学方程式表示) .
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示) .
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量 (填“相等”、“不相等”或“无法判断”).
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
请回答下列问题:
①上表中的”待测数据”的数值是 .
②此密闭容器内反应类型属于 (填基本反应类型).
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为 .
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有 气体,这是因为浓盐酸具有 性.
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从 (填“a”或“b”)端通入.
②若只需要把生成的气体干燥,可在瓶中盛放 .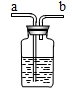
③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式 .
查看习题详情和答案>>
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示)
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量(g) | 43.6 | 待测数据 | 4.2 | 8.8 |
①上表中的”待测数据”的数值是
②此密闭容器内反应类型属于
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从
②若只需要把生成的气体干燥,可在瓶中盛放

③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式
兴化地处里下河地区,河港纵横,水系发达.但河水中含有较多的碳酸氢钙[Ca(HCO3)2],水的硬度较大.(查阅资料:碳酸氢钙易溶于水.当溶有碳酸氢钙的水遇热时,溶解在水里的碳酸氢钙就会发生分解,生成碳酸钙沉积下来,这就形成了水垢Ca(HCO3)2△CaCO3↓+H2O+CO2↑).已知碳酸氢钠、碳酸氢钾、碳酸氢镁等物质均能在加热条件下发生类似的反应.而碳酸钠、碳酸钾则在通常情况下比较稳定,加热不分解.
请你根据上述信息完成下列各题:
(1)根据上述信息可知,水垢的主要成分是________.你能用什么方法来除去水垢?(用化学方程式表示)________.
(2)若碳酸镁粉末中混有少量的碳酸氢镁,请写出除去杂质碳酸氢镁的方法(用化学方程式表示)________.
(3)实验室有两包质量均为10.6g的固体,分别是碳酸钠和碳酸氢钠.现分别经如下处理:①充分加热 ②滴加足量的稀盐酸 ③将两步反应生成的气体全部收集后通入足量的澄清石灰水.则生成沉淀的质量________(填“相等”、“不相等”或“无法判断”).
(4)在加热条件下密闭容器内发生某一化学反应,现对反应体系内的X、Y、Z、Q四种物质进行测定,测得数据如下:
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量(g) | 43.6 | 待测数据 | 4.2 | 8.8 |
①上表中的”待测数据”的数值是________.
②此密闭容器内反应类型属于________(填基本反应类型).
③若X是水,Q是能使澄清石灰水变浑浊的气体,且X、Y、Z、Q四种物质的化学计量数之比为1:1:2:1,则物质Y的相对分子质量为________.
(5)实验室制取二氧化碳时若不慎使用了浓盐酸,生成的气体中除混有水蒸气外还可能混有________气体,这是因为浓盐酸具有________性.
现要除去杂质气体,可采用如图所示的装置把不纯的气体进行洗气.
①不纯气体应从________(填“a”或“b”)端通入.
②若只需要把生成的气体干燥,可在瓶中盛放________.
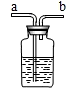
③可在瓶中盛放饱和的碳酸氢钠溶液除去另一种杂质气体.写出有关反应的化学方程式________. 查看习题详情和答案>>