摘要:答:(1)Fe+CuSO4===FeSO4+Cu 蓝色溶液变浅绿色溶液 (2)H2+CuO===Cu+H2O 由黑色固体的物质变为亮红色固体物质. (3)Cu2(OH)2CO3===2CuO+H2O+CO2↑ 绿色固体物质变为黑色固体物质.
网址:http://m.1010jiajiao.com/timu3_id_6068[举报]
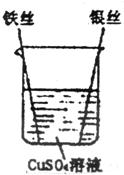 18、科学探究:铁、铜、银是初中化学课上学过的三种金属,实验设计如图所示.请回答:
18、科学探究:铁、铜、银是初中化学课上学过的三种金属,实验设计如图所示.请回答:(1)猜想该实验在探究的问题是
铁、铜、银金属活动性强弱
.(2)观察到的实验现象是铁丝表面
覆盖一层红色物质
,银丝表面
没有明显现象
,溶液由蓝色变成
浅绿色
.(3)得出的实验结论为:将铁、铜、银三种金属的活动性由弱到强顺序
填入下面的括号中(用元素符号填写)…(
Ag
)…(
Cu
)…(
Fe
)…(4)写出相关反应的化学方程式
Fe+CuSO4=FeSO4+Cu
. (2012?潍坊二模)化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理.请你参与并回答相关问题.
(2012?潍坊二模)化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理.请你参与并回答相关问题.实验一:表面除锈:
甲组:将锈铁器放入适量稀硫酸中,微热.观察到①溶液变成黄色,铁锈逐渐消失.一段时间后,②锈层完全消失,铁器表面有细小气泡产生,③黄色溶液逐渐变为浅绿色.
现象①发生的化学反应方程式为:
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
,②中铁器表面的气泡是氢气
氢气
;大家对现象③不理解,老师补充说明了,金属铁具有还原性,能将正三价的铁离子还原成亚铁离子.乙组:在锈铜钱中加入适量稀硫酸.观察到①绿色锈层很快消失,同时产生大量气泡,溶液变成蓝色.②将气体收集,通入澄清石灰水,石灰水变浑浊.由此,小军等同学推断,绿色锈层中肯定含有的元素有
铜元素、碳元素和氧元素
铜元素、碳元素和氧元素
.实验二:废液回收
废液桶中收集了溶有大量FeSO4、CuSO4的废水,若直接排放到下水道,不仅造成重金属污染而且浪费资源.小组讨论后设计了如下除去铜离子,回收硫酸亚铁晶体和铜的实验方案:
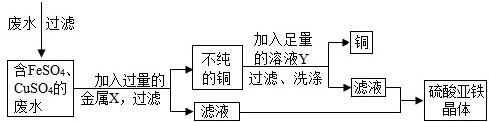
请完成下列有关问题:
(1)废水在加入金属X前需进行过滤,目的是将其中
不溶
不溶
性杂质除去.(2)金属X是
Fe(或铁)
Fe(或铁)
,其加入废水后发生反应的化学方程式为Fe+CuSO4═FeSO4+Cu
Fe+CuSO4═FeSO4+Cu
;溶液Y是稀硫酸
稀硫酸
,利用其除去铜中杂质,有关反应的化学方程式为Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
.(3)从滤液中获取硫酸亚铁晶体的操作方法是
结晶(或蒸发结晶或冷却结晶)
结晶(或蒸发结晶或冷却结晶)
. (2012?密云县二模)化学实验课上老师要求分组除去铁制品和锈铜币表面
(2012?密云县二模)化学实验课上老师要求分组除去铁制品和锈铜币表面的锈层并对废液进行处理.请你参与并回答相关问题.
(1)实验一:表面除锈
甲组:将锈铁器放入适量稀硫酸中,微热.观察到①溶液变成黄色,铁锈逐渐消失.一段时间后,②锈层完全消失,铁器表面有细小气泡产生,③黄色溶液逐渐变为浅绿色.
1)现象①发生的化学反应方程式为:
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
,2)②中铁器表面的气泡是什么气体
氢气
氢气
;3)大家对现象③不理解,老师提示大家:金属单质铁和铜都可以将+3价的铁元素转变为+2价铁元素,其中铜发生的反应过程为2FeCl3+Cu→2FeCl2+CuCl2.
请你根据老师的提示推测产生现象③的原因
Fe+Fe2(SO4)3=3FeSO4
Fe+Fe2(SO4)3=3FeSO4
.(只写出有关反应的化学方程式)乙组:(1)在锈铜钱中加入适量稀硫酸.观察到①绿色锈层很快消失,同时产生大量气泡,溶液变成蓝色.②将气体收集,通入澄清石灰水,石灰水变浑浊.由此,小军等同学推断,绿色铜锈层中肯定含有的元素有
铜元素、碳元素和氧元素
铜元素、碳元素和氧元素
.(2)实验二:废液回收
废液桶中收集了溶有大量FeSO4、CuSO4的废水,若直接排放到下水道,不仅造成重金属污染而且浪费资源.小组讨论后设计了如下回收硫酸亚铁晶体和铜的实验方案:

请完成下列有关问题:
1金属X是
Fe(或铁)
Fe(或铁)
,其加入废水后发生反应的化学方程式为Fe+CuSO4═FeSO4+Cu
Fe+CuSO4═FeSO4+Cu
;2利用溶液Y除去铜中杂质,有关反应的化学方程式为
Fe+H2SO4═FeSO4+H2↑
Fe+H2SO4═FeSO4+H2↑
.