摘要:10.对于平衡体系A(g)+B(g)C(g)+D(g) ΔH <0.下列结论中不正确的是 A.若温度不变.将容器的体积缩小到原来的一半.此时A的浓度为原来的2.1倍.则+<+ B.若平衡时.A.B的转化率相等.说明反应开始时.A.B的物质的量之比为∶ C.若+=+,则往含有 mol气体的平衡体系中再加入mol的B.达到新平衡时.气体的总物质的量等于2 D.若温度不变时.压强增大到原来的2倍.达到新平衡时.总体积一定比原来的1/2要小
网址:http://m.1010jiajiao.com/timu3_id_60400[举报]
对于平衡体系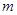 A(g)+
A(g)+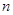 B(g)
B(g)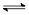
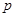 C(g)+
C(g)+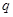 D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则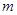 +
+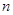 <
<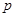 +
+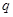
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为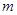 ∶
∶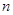
C.若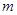 +
+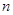 =
=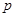 +
+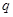 ,则往含有
,则往含有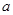 mol气体的平衡体系中再加入
mol气体的平衡体系中再加入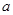 mol的B,达到新平衡时,气体的总物质的量等于2
mol的B,达到新平衡时,气体的总物质的量等于2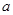
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
查看习题详情和答案>>
对于平衡体系![]() A(g)+
A(g)+![]() B(g)
B(g)![]()
![]() C(g)+
C(g)+![]() D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是
若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则![]() +
+![]() <
<![]() +
+![]()
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为![]() ∶
∶![]()
C.若![]() +
+![]() =
=![]() +
+![]() ,则往含有
,则往含有![]() mol气体的平衡体系中再加入
mol气体的平衡体系中再加入![]() mol的B,达到新平衡时,气体的总物质的量等于2
mol的B,达到新平衡时,气体的总物质的量等于2![]()
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
查看习题详情和答案>>对于平衡体系![]() A(g)+
A(g)+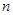 B(g)
B(g)![]() C(g)+
C(g)+![]() D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是
A.若温度不变,将容器的体积缩小到原来的一半,此时A的浓度为原来的2.1倍,则![]() +
+![]() <
<![]() +
+![]()
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为![]() ∶
∶![]()
C.若![]() +
+![]() =
=![]() +
+![]() ,则往含有
,则往含有![]() mol气体的平衡体系中再加入
mol气体的平衡体系中再加入![]() mol的B,达到新平衡时,气体的总物质的量等于2
mol的B,达到新平衡时,气体的总物质的量等于2![]()
D.若温度不变时,压强增大到原来的2倍,达到新平衡时,总体积一定比原来的1/2要小
查看习题详情和答案>>
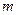 A(g)+
A(g)+ B(g)
B(g)
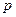 C(g)+
C(g)+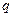 D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是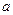 mol气体的平衡体系中再加入
mol气体的平衡体系中再加入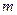 A(g)+
A(g)+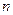 B(g)
B(g)
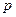 C(g)+
C(g)+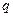 D(g) ΔH <0,下列结论中不正确的是
D(g) ΔH <0,下列结论中不正确的是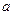 mol气体的平衡体系中再加入
mol气体的平衡体系中再加入