摘要: (1)电池总反应为 2Na+xS Na2Sx 正极反应式:xS+2e-=Sx2- 负极反应式:2Na-2e-=2Na+ (2)电解混合溶液时. 阳极先后发生下列反应: 2Cl--2e-=Cl2↑,4OH--4e-=2H2O+O2↑ 阴极先后发生下列反应: Cu2++2e-=Cu,2H++2e-=H2↑ 由于消耗23gNa.电路中有1mol电子转移.即阳极.阴极均消耗1mol电子. 对于阳极:使Cl-全部放电产生0.1mol Cl2耗0.2mol e-.另有0.8mol e-使OH-放电产生O2 0.2mol. 共产生气体=0.3mol×22.4L·mol-1=6.72L 对于阴极:使Cu2+全部放电需耗0.4mol e-.另有0.6mol e-使0.6mol H+放电. 比较阴极.阳极.有0.6mol H+.0.8mol OH-分别放电.故溶液中产生0.2mol H+
网址:http://m.1010jiajiao.com/timu3_id_60291[举报]
|
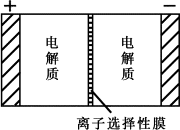
一种大型蓄电系统的电池总反应为:2Na2S2+NaBr3 中的左右两侧为电极,中间为离子选择性膜(在电池放电和充电时该膜允许钠离 子通过);放电前,被膜隔开的电解质为Na2S2和NaBr3,放电后,分别变为Na2S4 和NaBr.下列说法正确的是
| |
| [ ] | |
A. |
充电过程中,Na+离子的流向为从右到左 |
B. |
充电过程中,阳极的电极反应为:3NaBr-2e-=NaBr3+2Na+ |
C. |
放电前,左侧电解质为Na2S2,右侧电解质为NaBr3 |
D. |
放电过程中,电子由负极通过外电路流向正极 |
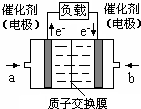 可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路.质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法正确的是( )
可给笔记本电脑供电的甲醇燃料电池已经面世,其结构示意图如下.甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路.质子经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2=2CO2+4H2O.下列说法正确的是( )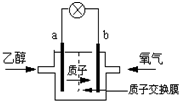 一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )
一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍.电池总反应为:C2H5OH+3O2=2CO2+3H2O,电池示意图如图.下面对这种电池的说法正确的是( )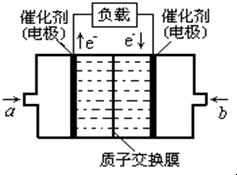 甲醇燃料电池已经面世,其结构示意图如图.甲醇在催化作用下提供质子(H+)和电子,电子经外电路、质子(H+)经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2═2CO2+4H2O,下列说法不正确的是( )
甲醇燃料电池已经面世,其结构示意图如图.甲醇在催化作用下提供质子(H+)和电子,电子经外电路、质子(H+)经内电路到达另一电极后与氧气反应,电池总反应为:2CH3OH+3O2═2CO2+4H2O,下列说法不正确的是( )