摘要: N>S>Si (2)N2O4 第四周期ⅤA 3d54s2 (3) N2.CO.C22-.CN- 1 8 解析:(1) SiO32-.SO32-.NO3-三种离子中中心原子的杂化类型均为sp2杂化.离子构型为平面正角形.键角为120°(3)π键和σ键共存在.多重键中只有一个是σ键.其余均为π键.如双键中有1个σ键和1个π键.叁键中有1个σ键和2个π键.(4)PO43-中P原子以4个sp3杂化轨道和4个O原子成键.所以P为4配位氧.根据题意可先计算出Si晶胞中Si原子数:8×+6×+4=8(个).SiO2晶胞中Si原子数目与硅晶胞中Si原子数目相同.再可结合SiO2晶体中硅氧原子数目1:2的特点可确定晶胞中O原子数有16个(对题中描述的复杂结构可视为干扰条件).
网址:http://m.1010jiajiao.com/timu3_id_60219[举报]
如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是 ( )
①C ②N ③Si ④S ⑤Cl
A.①② B.②⑤ C.③④ D.②④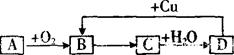
如图,A~D四种物质均含有同一种元素,A是非金属单质,D是最高价氧化物对应的水化物,则A、B、C、D中共同含有的元素可能是 ( )
①C ②N ③Si ④S ⑤Cl
A.①② B.②⑤ C.③④ D.②④

气态SO3分子中硫原子6个价电子均成键,3个S、O共价键键长都为153pm,冷却为固体时形成聚合分子.则关于气态SO3的叙述错误的是( )
| A、是非极性分子 | B、分子呈平面正三角形 | C、3个S、O键都是单键 | D、聚合时放出热量 |
|
下列说法中正确的是 | |
| [ ] | |
A. |
BF3、NF3分子的价层电子对互斥模型均为平面正三角形 |
B. |
H-Cl的键能为431.8 kJ·mol-1,H-I的键能为298.7 kJ·mol-1,这可以说明HCl分子比HI分子稳定 |
C. |
可燃冰是甲烷的结晶水合物,甲烷可与水形成氢键 |
D. |
因为N-H键能比P-H大,所以NH3沸点比PH3高 |
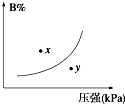 反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )