题目内容
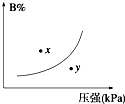 反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )①m+n>p
②x点表示的正反应速率大于逆反应速率
③x点比y点时的反应速率慢
④n>p
⑤若升高温度,该反应的平衡常数增大.
分析:由图象可以看出,增大压强,B%增大,说明平衡向逆反应方向移动,则有n<p,注意A为固体的特征,在曲线上的点为平衡状态,图象中x和y没有达到平衡状态,根据B的含量判断反应趋向于平衡分析反应进行的方向,正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,据此解答.
解答:解:①A为固态,压强对该物质无影响,由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,则有n<p,故①错误;
②x点位于曲线上方,未达到平衡状态,由图象可以看出,当B的含量减小时,可趋向于平衡,则应是向正反应方向移动,即V正>V逆,故②正确;
③由图象可以看出x点的压强小于y点压强,压强越大,反应速率越大,故x点比y点的反应速率慢,故③正确;
④由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,则有n<p,故④错误;
⑤正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,故⑤错误;
故选C.
②x点位于曲线上方,未达到平衡状态,由图象可以看出,当B的含量减小时,可趋向于平衡,则应是向正反应方向移动,即V正>V逆,故②正确;
③由图象可以看出x点的压强小于y点压强,压强越大,反应速率越大,故x点比y点的反应速率慢,故③正确;
④由图象的曲线变化特征可以看出,增大压强,B的百分含量增大,说明平衡向逆反应方向移动,则有n<p,故④错误;
⑤正反应为放热反应,升高温度平衡向逆反应方向移动,平衡常数减小,故⑤错误;
故选C.
点评:本题考查化学平衡图象问题,题目难度不大,注意根据图象判断化学平衡的移动方向,注意分析纵坐标随横坐标变化的趋势,特别是曲线的上的点与曲线外的点的区别.答题时注意A为固体的特点,为易错点.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
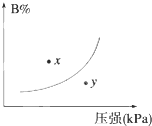 反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )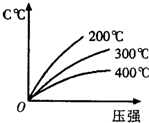 反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
反应mA(s)+nB(g)?eC(g)+fD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )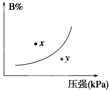 反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )
反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下,平衡时B的体积分数(B%)与压强变化的关系如图所示,下列叙述中一定正确的是( )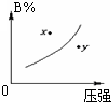 已知反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下达到平衡时B的体积分数(B%)与压强的关系如图所示,下列判断错误的是( )
已知反应mA(s)+nB(g)?pC(g)△H<0,在一定温度下达到平衡时B的体积分数(B%)与压强的关系如图所示,下列判断错误的是( )