摘要:11.答案: (1)Zn – 2e- = Zn2+ 2H+ + 2e- = H2↑ (2)①锌片与银片减少的质量等于生成氢气所消耗的锌的质量.设产生的氢气体积为x. Zn + 2H+ = Zn2+ + H2↑ 65 g 22.4 L 60 g – 47 g = 13 g x x = 13 g×22.4 L ÷ 65 g = 4.5 L ②反应消耗的锌为: 13 g ÷ 65 g/mol = 0.20 mol 1 mol Zn变为Zn2+时.转移2 mol e-.则通过的电量为:
网址:http://m.1010jiajiao.com/timu3_id_59926[举报]
(1)1799年,意大利物理学家伏特制成了世界上第一个电池-“伏打”电池,直接促进了人类文明的发展.下列①~⑤装置中,能构成原电池的是

(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
工业合成氨的反应是
查看习题详情和答案>>
①
①
(填序号),其正极反应式为2H++2e-=H2↑
2H++2e-=H2↑
,负极反应式为Zn-2e-=Zn 2+
Zn-2e-=Zn 2+
,电子向正极
正极
(填“正极”或“负极”,下同)运动,H+向正极
正极
运动.
(2)合成氨是人类科学技术发展史上的一项重大突破.德国化学家哈伯和化学工程专家博斯因为研究工业合成氨分获1918年和1931年的诺贝尔化学奖.
①工业合成氨反应的化学方程式为
N2(g)+3H2(g)
2NH3(g)
| ||
| 高温高压 |
N2(g)+3H2(g)
2NH3(g)
.
| ||
| 高温高压 |
②化学反应中的能量变化是断裂旧化学键吸收的能量之和与形成新化学键释放的能量之和的差.依据下表计算:
| 化学键 | H-H | N≡N | H-N |
| 生成(或断裂)1mol化学键时放出(或吸收)的能量 | 436kJ | 946kJ | 390kJ |
放热
放热
(填“放热”或“吸热”)反应,1molN2完全反应时对应热量的数值为92
92
kJ.锌锰干电池是最早使用的化学电池,其基本构造如图1所示.
(1)锌锰干电池的负极电极反应式是
(2)某研究小组对电池内黑色糊状物进行了如图2所示实验

已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
(3)利用残渣中分离出的MnO2,研究其在H2O2制O2过程中的作用.实验装置如图3所示.将等物质的量浓度、等体积H2O2溶液加入分液漏斗中,分别进行2个实验(气体的体积在相同条件下测定).
①实验一、二中参加反应的H2O2的物质的量之比为
②实验二中反应的离子方程式为
③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意
查看习题详情和答案>>
(1)锌锰干电池的负极电极反应式是
Zn-2e-═Zn2+
Zn-2e-═Zn2+
,电路中每通过0.4mol e-,负极质量减少13.0
13.0
g;工作时NH4+离子在正极放电产生2种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是2NH4++2e-═2NH3↑+H2↑
2NH4++2e-═2NH3↑+H2↑
.(2)某研究小组对电池内黑色糊状物进行了如图2所示实验

已知:Zn(OH)2是两性氢氧化物.完成下列实验报告:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量上述无色溶液于试管中,逐滴加入NaOH溶液,直至过量. | 生成白色沉淀, 白色沉淀逐渐溶解,产生刺激性气味的气体 白色沉淀逐渐溶解,产生刺激性气味的气体 |
无色溶液中 存在Zn2+离子 |
| ② 将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口 将溶液加热,并将湿润的红色石蕊试纸贴在玻璃棒的一端置于试管口 |
红色石蕊试纸变蓝 红色石蕊试纸变蓝 |
无色溶液中 存在NH4+离子 |
| 序号 | 烧瓶中的物质 | 实验记录 | 实验结论与解释 |
| 实验一 | 足量MnO2 | 收集到56mL气体 | MnO2做催化剂 |
| 实验二 | 足量MnO2 和稀硫酸 |
黑色粉末部分溶解, 收集到112mL气体 |
MnO2做氧化剂 MnO2做氧化剂 生成Mn2+离子 生成Mn2+离子 |
1:1
1:1
;②实验二中反应的离子方程式为
H2O2+2H++MnO2═Mn2++2H2O+O2↑
H2O2+2H++MnO2═Mn2++2H2O+O2↑
;③在测量气体体积时,除要注意待气体温度恢复至室温、平视读数外,还需要注意
上下移动B管,使A、B两管中液面相平
上下移动B管,使A、B两管中液面相平
. 如图,外接电源为Zn-MnO2干电池,甲、乙为相互串联的两个电解池,请回答:
如图,外接电源为Zn-MnO2干电池,甲、乙为相互串联的两个电解池,请回答:(1)甲池若为用电解原理精炼铜的装置,B电极是
阳
阳
极,材料是粗铜
粗铜
A电极反应式为Cu2++2e-═Cu
Cu2++2e-═Cu
,电解质溶液可以是CuSO4溶液(CuCl2溶液)
CuSO4溶液(CuCl2溶液)
(2)乙池中Fe极是
阴
阴
极,若滴入少量酚酞试液,开始一段时间后,Fe极附近呈红
红
色,若C电极材料为石墨,C电极反应式为
2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
(3)Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.该电池的负极材料是
锌
锌
,电极反应式为Zn-2e-═Zn2+
Zn-2e-═Zn2+
.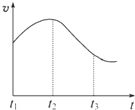 (思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
(思维拓展题)某研究学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:实验一、把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验二、把纯锌片投入到含FeCl3的同浓度工业稀盐酸中,发现放出氢气量减少.
实验三、将不纯的锌片与稀盐酸反应,发现反应速率加快.
实验四、在盐酸中滴入几滴CuCl2溶液,同样生成氢气速率加快.
问题:
(1)试分析实验一中t1~t2速率变化的主要原因是
纯锌与稀盐酸反应,放出热量,温度升高
纯锌与稀盐酸反应,放出热量,温度升高
,t2~t3速率变化的主要原因是随着反应进行c(H+)降低
随着反应进行c(H+)降低
.(2)实验二放出氢气量减少的原因是
锌片与FeCl3反应,导致与盐酸反应的锌的质量减少
锌片与FeCl3反应,导致与盐酸反应的锌的质量减少
.(3)某同学认为实验三和四反应速率加快原因,均因为原电池的存在,你认为是否正确,若不正确,说明原因.若正确写出原电池的电解质溶液、正、负极材料及电极反应.
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 负极材料 | 正极材料 | 负极反应式 | 正极反应式 | 电解质溶液 | |
| 实验三 | Zn | 杂质 | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |
| 实验四 | Zn | Cu | Zn-2e-=Zn2+ | 2H++2e-=H2↑ | 盐酸 |