摘要:14.答案:(1)水泥,△H1-3△H2+18△H3(2).Na5P3O10.(3)+1,2Ni2+ + 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应,电镀通过外加电流.在镀件外形成镀层 ,化学镀是利用化学腐蚀反应,电镀是利用电解池.外加电流进行氧化还原反应 , 装置简便.节约能源.操作简便 . [解析](1)①由方程式可以看出副产物矿渣应该是CaSiO3(s).结合炼铁我们不难得出答案是制水泥. ②运用盖斯定律.反应1-反应2×3+反应3×18=总反应.则△H=△H1-3△H2+18△H3 (2)结合题意三聚磷酸钠可知产物三聚磷酸应含有五个羟基.即三个 磷酸分子之间有三个羟基相互反应脱去两个水分子.所以三聚磷酸的结构式为 .三聚磷酸钠的化学式为Na5P3O10. (3)①因为Na.H的化合价为+1.O为-2.所以由化合价代数和为0可得P的化合价为:+1. ②由得失电子数目守恒×1.可知Ni2+ 和Ni+的化学计量数为2.H2PO2-和H2PO3-的化学计量数为1.再由电荷守恒2×2-1=2×1-1+2×1.可知H+在方程式的右边.H2O在方程式的左边.化学计量数分别为2和1.即总方程式为: 2Ni2+ +1H2PO2-+ 1H2O→2Ni+ +1H2PO3-+ 2 H+ ③比较化学镀与电镀应该从反应环境和条件以及反应实质和产物方面去分析归纳问题.从方法上分析.电镀是利用电解原理通过外加直流电源.在镀件表面形成的镀层.镀层一般只有镍.而化学镀是利用氧化还原反应镀件直接与电解质溶液接触.在塑料镀件表面沉积镍-磷合金.这是两者的不同,从原理上分析.无论电镀还是化学镀均有电子的转移.均是利用了氧化还原反应.这是两者的相同点.不同点是化学镀用的是化学反应.而电镀用的是电化学,很明显化学镀装置简单.而且不需要消耗电能.装置简单.耗能少.操作简便应该是化学镀优于电镀的. () 来源: 版权所有:() 版权所有:() 版权所有:()
网址:http://m.1010jiajiao.com/timu3_id_59631[举报]
 (2009?广东)磷单质及其化合物的有广泛应用.
(2009?广东)磷单质及其化合物的有广泛应用.(1)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
①上述反应中,副产物矿渣可用来
生产水泥等建筑材料
生产水泥等建筑材料
.②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=
△H1+3△H2+18△H3
△H1+3△H2+18△H3
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个分子产物,其结构式为
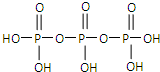
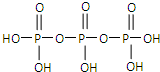
Na5P3O10
Na5P3O10
(3)次磷酸钠(NaH2PO2)可用于化学镀镍.
①NaH2PO2中P元素的化合价为
+1
+1
.②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a)
1
1
Ni2++1
1
H2PO2-+H2O
H2O
→1
1
Ni+1
1
H2PO3 -+2H+
2H+
(b)6H2PO2-+2H+=2P+4H2PO3-+3H2↑
请在答题卡上写出并配平反应式(a).
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀.请从以下方面比较化学镀与电镀.
方法上的不同点:
化学镀无需通电,而电镀需要通电
化学镀无需通电,而电镀需要通电
;原理上的相同点:都利用氧化还原反应
都利用氧化还原反应
;化学镀的优点:化学镀对镀件的导电性无特殊要求
化学镀对镀件的导电性无特殊要求
.(2013?武昌区模拟)全世界每年被腐蚀损耗的钢铁量非常惊人,在潮湿空气中发生吸氧腐蚀是钢铁腐蚀的主要原因.
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为
(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
CO↑+CO2↑+H2O,下列装置中,可用作草酸分解制取气体的是

(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是
a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液 d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)
③E装置的作用是
④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
⑤在本实验中,下列情况会使测定结果n偏大的是
a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3?nH2O.
查看习题详情和答案>>
(1)在潮湿空气中,钢铁发生吸氧腐蚀时的负极反应的电极反应式为
Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(2)已知草酸(H2C2O4)分解的化学方程式为:H2C2O4
| 浓硫酸 | 加热 |
d
d
(填答案编号).
(3)某实验小组为测定铁锈样品的组成(假定铁锈中只有Fe2O3?nH2O和Fe两种成份),利用草酸分解产生的CO和铁锈反应,实验装置如下图所示.

①为得到干燥、纯净的CO气体,洗气瓶A、B中盛放的液态试剂依次可能是
c
c
、a
a
(填答案编号).a.浓硫酸 b.澄清的石灰水 c.氢氧化钠溶液 d.无水氯化钙
②在点燃C处酒精灯之前应进行的操作是:(a)检查装置气密性;(b)
通入混合气体一段时间,排除体系中的空气,防止加热时CO发生爆炸
通入混合气体一段时间,排除体系中的空气,防止加热时CO发生爆炸
.③E装置的作用是
防止空气中的CO2和H2O进入体系,影响实验结果
防止空气中的CO2和H2O进入体系,影响实验结果
,上述装置最后尾气处理的方法是点燃
点燃
.④准确称量样品的质量10.00g置于硬质玻璃管中,充分反应后冷却、称量(假设每步均完全反应),硬质玻璃管中剩余固体质量为8.32g,D中浓硫酸增重0.72g,则n=
2
2
.⑤在本实验中,下列情况会使测定结果n偏大的是
a
a
(填答案编号).a.缺少装置B b.缺少装置E c.反应后的固体中有少量Fe2O3?nH2O.
在常温下,0.1mol/L一元酸HB溶液的PH=3.试回答下列问题:
(1)HB在水溶液中的电离方程式为
(2)在常温下,0.1mol/L一元酸HB溶液中由水电离出的H+物质的量浓度是
A.10-11mol/L B.10-9mol/L C.10-6mol/L D.以上答案都不正确
(3)在常温下,将0.1mol/L一元酸HB溶液稀释100倍后,溶液的PH
查看习题详情和答案>>
(1)HB在水溶液中的电离方程式为
HB?H++B-
HB?H++B-
,100mL0.1mol/L一元酸HB溶液和0.1mol/LNaOH溶液恰好完全反应时,所需NaOH溶液的体积为100
100
mL.(2)在常温下,0.1mol/L一元酸HB溶液中由水电离出的H+物质的量浓度是
10-11mol/L
10-11mol/L
;若将温度改变到t℃(此时Kw=10-12),则t>
>
25(<、>或=),该温度下0.1mol/L一元酸HB溶液中由水电离出的H+物质的量浓度D
D
.A.10-11mol/L B.10-9mol/L C.10-6mol/L D.以上答案都不正确
(3)在常温下,将0.1mol/L一元酸HB溶液稀释100倍后,溶液的PH
<
<
5(<、>或=).(1)写出H2S的电离方程式
(2)写出熔融状态下硫酸氢钠的电离方程式
(3)已知1g氢气完全燃烧生成液态水放出143KJ热量,写出表示H2燃烧热热化学方程式
(4)已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
用△H1、△H2和△H3表示△H,△H=
查看习题详情和答案>>
H2S?H++HS-HS-、HS-?H++S2-
H2S?H++HS-HS-、HS-?H++S2-
;(2)写出熔融状态下硫酸氢钠的电离方程式
NaHSO4=Na++HSO4-
NaHSO4=Na++HSO4-
;(3)已知1g氢气完全燃烧生成液态水放出143KJ热量,写出表示H2燃烧热热化学方程式
H2(g)+
O2(g)=H2O(l)△H=-286kJ?mol-1
| 1 |
| 2 |
H2(g)+
O2(g)=H2O(l)△H=-286kJ?mol-1
;| 1 |
| 2 |
(4)已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
用△H1、△H2和△H3表示△H,△H=
△H1+3△H2+18△H3
△H1+3△H2+18△H3
.