题目内容
(1)写出H2S的电离方程式
(2)写出熔融状态下硫酸氢钠的电离方程式
(3)已知1g氢气完全燃烧生成液态水放出143KJ热量,写出表示H2燃烧热热化学方程式
(4)已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
用△H1、△H2和△H3表示△H,△H=
H2S?H++HS-HS-、HS-?H++S2-
H2S?H++HS-HS-、HS-?H++S2-
;(2)写出熔融状态下硫酸氢钠的电离方程式
NaHSO4=Na++HSO4-
NaHSO4=Na++HSO4-
;(3)已知1g氢气完全燃烧生成液态水放出143KJ热量,写出表示H2燃烧热热化学方程式
H2(g)+
O2(g)=H2O(l)△H=-286kJ?mol-1
| 1 |
| 2 |
H2(g)+
O2(g)=H2O(l)△H=-286kJ?mol-1
;| 1 |
| 2 |
(4)已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)=CaSiO3(s)△H3
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
用△H1、△H2和△H3表示△H,△H=
△H1+3△H2+18△H3
△H1+3△H2+18△H3
.分析:(1)H2S属于二元弱酸,存在电离平衡,H2S电离氢离子与硫氢根离子,硫氢根离子发生二级电离,电离出氢离子与硫离子;
(2)硫酸氢钠是离子化合物,由钠离子与硫酸氢根离子构成,熔融状态下电离出钠离子与硫酸氢根离子;
(3)H2燃烧热的热化学方程式中,氢气的物质的量为1mol,生成的水为液态,计算1g氢气的物质的量,进而计算1mol氢气完全燃烧生成液态水放出的热量,再结合热化学方程式的书写原则进行书写H2燃烧热的热化学方程式;
(4)根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算.
(2)硫酸氢钠是离子化合物,由钠离子与硫酸氢根离子构成,熔融状态下电离出钠离子与硫酸氢根离子;
(3)H2燃烧热的热化学方程式中,氢气的物质的量为1mol,生成的水为液态,计算1g氢气的物质的量,进而计算1mol氢气完全燃烧生成液态水放出的热量,再结合热化学方程式的书写原则进行书写H2燃烧热的热化学方程式;
(4)根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算.
解答:解:(1)H2S属于二元弱酸,存在电离平衡,H2S电离氢离子与硫氢根离子,电离方程式为:H2S?H++HS-HS-;
硫氢根离子发生二级电离,电离出氢离子与硫离子,电离方程式为:HS-?H++S2-;
故答案为:H2S?H++HS-HS-、HS-?H++S2-;
(2)硫酸氢钠是离子化合物,由钠离子与硫酸氢根离子构成,熔融状态下电离出钠离子与硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-;
故答案为:NaHSO4=Na++HSO4-;
(3)1g氢气的物质的量为
=0.5mol,所以1mol氢气完全燃烧生成液态水放出的热量为143kJ×
=286kJ,所以H2燃烧热的热化学方程式为:H2(g)+
O2(g)=H2O(l)△H=-286kJ?mol-1;
故答案为:H2(g)+
O2(g)=H2O(l)△H=-286kJ?mol-1;
(4)已知:①4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
③SiO2(s)+CaO(s)=CaSiO3(s)△H3
根据盖斯定律,①+②×3+③×18得:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
△H=△H1+3△H2+18△H3;
故答案为:△H1+3△H2+18△H3.
硫氢根离子发生二级电离,电离出氢离子与硫离子,电离方程式为:HS-?H++S2-;
故答案为:H2S?H++HS-HS-、HS-?H++S2-;
(2)硫酸氢钠是离子化合物,由钠离子与硫酸氢根离子构成,熔融状态下电离出钠离子与硫酸氢根离子,电离方程式为:NaHSO4=Na++HSO4-;
故答案为:NaHSO4=Na++HSO4-;
(3)1g氢气的物质的量为
| 1g |
| 2g/mol |
| 1mol |
| 0.5mol |
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(4)已知:①4Ca5(PO4)3F(s)+3SiO2(s)=6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
②2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g)△H2
③SiO2(s)+CaO(s)=CaSiO3(s)△H3
根据盖斯定律,①+②×3+③×18得:
4Ca5(PO4)3F(s)+2lSiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
△H=△H1+3△H2+18△H3;
故答案为:△H1+3△H2+18△H3.
点评:考查电离方程式、有关反应热的计算、燃烧热及热化学方程式书写等,难度中等,注意对燃烧热的理解,(4)中注意理解盖斯定律,关键是构造目标热化学方程式.

练习册系列答案
相关题目
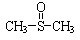 ),有关反应如下:
),有关反应如下: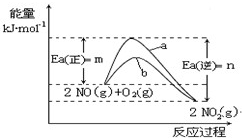
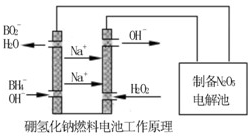
 (1)写出Si的基态原子价电子排布式 。
(1)写出Si的基态原子价电子排布式 。 (1)写出Si的基态原子价电子排布式
。
(1)写出Si的基态原子价电子排布式
。