摘要:12.答案: (1)Cu.O (2)b.c (3)2Fe3++2I-=2Fe2++I2 S2O82-+2Fe2+=2SO42-+2Fe3+(离子方程式不配平不扣分) (4)a:稀硫酸.KMnO4溶液 b:稀硫酸浸取炉渣所得溶液能使KMnO4溶液褪色 [解析](1)若CuFeS2中Fe的化合价为+2,则Cu化合价为+2,S化合价为-2.分析化学方程式两边元素化合价的变化可知.化合价降低的元素被还原.有Cu和O元素.关于SO2的吸收问题.一是不能高空排放.因为这样做.没有从根本上解决污染问题,二是不能用浓硫酸吸收.因SO2难溶于浓硫酸.只有变废为宝.才能符合“绿色化学 的概念.答案选b.c. (2)此题要从催化剂的本质出发.作为催化剂的物质要参与有关反应.但后来的反应必须又生成了催化剂.本题要求写出表示Fe3+作催化剂的反应.因此.首先Fe3+要参与反应.即有反应2Fe3++2I-=2Fe2+ +I2.生成的Fe2+又被S2032-氧化生成了Fe3+.此题若要求写出Fe2+对上述反应的作催化剂的话.就应写成如下方程式:S2082-+Fe2+=2SO42-+2Fe3+.2Fe3++2I-=2Fe2+ +I2.虽是二个相同反应方程式.由于二者的前后顺序的颠倒.却产生了本质的区别. (3)此题考查是混合物的分离与提纯及常见离子的鉴别.因Al2O3溶于酸后生成了Al3+.Al3+又能与过量NaOH的反应生成可溶性的钠盐(NaAlO2).然后将溶液中的难溶物Fe(OH)3沉淀过滤出来.将沉淀洗涤.干燥.煅烧得Fe2O3.故除去Al3+的离子方程式是Al3++4OH-=AlO2-+2H2O.要证明炉渣中含有FeO的方法.最好利用Fe2+的还原性.先将混合物溶于过量的稀硫酸中(FeO→Fe2+).然后滴入KMn04溶液.观察其溶液是否褪色.注意所用酸不能是硝酸或盐酸.因硝酸会将Fe2+氧化成Fe3+,盐酸会还原KMn04溶液而使之褪色.干扰了Fe2+的检验.
网址:http://m.1010jiajiao.com/timu3_id_59629[举报]
图1是化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图.其中装置Ⅰ为甲同学设计.(可能用到的相对原子质量:H:1 C:12 N:14 O:16 Cu:64 )
请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为______.
(2)乙同学认为装置Ⅰ中收集的气体不能确定铜与稀硝酸反应生成的是NO气体,理由是______.于是他设计装置Ⅱ,其中装铜片的是气球.
(3)化学研究性学习小组的其它同学对上述实验进行了研究,认为装置Ⅱ只能定性研究铜与硝酸的反应,他们又重新设计了一套实验,装置图如图2:a中盛有标况下的空气(氧气占五分之一)和10mL,1.2mol/L硝酸的250mL烧瓶.b是未充气(实验开始前内部没有气体)放有0.384g铜粉的气球.(整套装置已经过气密性检查合格.)他们做了以下实验,请填写有关空白:
①将气球中的铜粉小心倒入烧瓶中,充分反应后发现 铜粉有余(设产生的气体不溶解于溶液中),则可观察到的是______;
②将烧瓶不断振荡发现气球逐渐缩小,发生有关反应的化学方程式是:______;
③打开弹簧夹将二氧化碳慢慢推入干燥管内继续振荡,使气体与气体、溶液充分接触,欲使所有的铜粉都溶解,至少需要推入二氧化碳______ml;
④将上述全过程用一个总的化学方程式表示:______.
查看习题详情和答案>>
下列各组物质依次表示为a、b、c、d,图中箭头表示一步转化。满足如图所示转化关系的是 ( )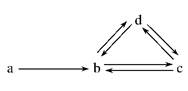
| A.Na Na2O2 NaOH Na2CO3 | B.S SO2 H2SO3 NaHSO3 |
| C.Cu CuO Cu(OH)2 CuSO4 | D.Si SiO2 H2SiO3 Na2SiO3 |
氯化铜溶液中含有FeCl3杂质,若要制得较纯净的氯化铜,可向溶液中加入( )?
①CuO ②NaOH ③CuCO3 ④Cu(NO3)2 ⑤NH3·H2O?
A.⑤ B.②③?
C.①③ D.②④?
查看习题详情和答案>>