摘要:32.答案: (1)[Ar]3d9或1s22s22p63s23p63d9. BD. (4)F的电负性比N大.N-F成键电子对向F偏移.导致NF3中N原子核对其孤对电子的吸引能力增强.难以形成配位键.故NF3不易与Cu2+形成配离子. (5)高 Cu2O与Cu2S相比.阳离子相同.阴离子所带的电荷数也相同.但O2-半径比S2-半径小.所以Cu2O的晶格能更大.熔点更高. [解析](2)用均摊法可知含阴离子数为:8×+4×+2×+1 = 4. (3)端点的原子不杂化.而图示结构的SO4单元中含有端点氧原子.所以A项不正确.铜离子与SO42 -之间存在离子键.B项正确.胆矾是离子晶体.C项不正确.由图结构可知.胆矾中有1个水分子与其它粒子靠氢键结合.易失去.有4个水分子与Cu2+以配位键结合.较难失去.所以D项正确. (4)对比NH3与NF3结构可知.F的电负性比N大.N-F成键电子对向F偏移.使NF3中N原子上显正电性.难以形成配位键.
网址:http://m.1010jiajiao.com/timu3_id_59575[举报]
 (2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.
(2009?广东)铜单质及其化合物在很多领域有重要的用途,如金属铜用来制造电线电缆,五水硫酸铜可用作杀菌剂.(1)Cu位于元素周期表第I B族.Cu2+的核外电子排布式为
[Ar]3d9或1s22s22p63s23p63d9
[Ar]3d9或1s22s22p63s23p63d9
.(2)右图是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为
4
4
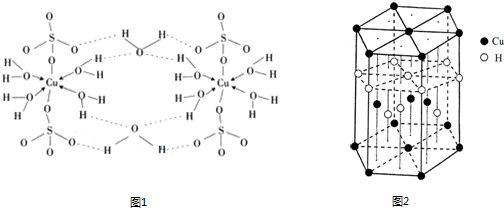
.(3)胆矾CuSO4?5H2O可写成[Cu(H2O4)]SO4?H2O,其结构示意图如下:

下列说法正确的是
ABD
ABD
(填字母).A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.在上述结构示意图中,存在配位键、共价键和离子键
C.胆矾是分子晶体,分子间存在氢键
D.胆矾中的水在不同温度下会分步失去
(4)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是
F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键.)
F的电负性比N大,N-F成键电子对向F偏移,导致NF3中N原子核对其孤对电子的吸引能力增强,难以形成配位键,故NF3不易与Cu2+形成配离子(或者N、F、H三种元素的电负性:F>N>H,在NF3中,共用电子对偏向F,偏离N原子使得氮原子上的孤对电子难于与Cu2+形成配位键.)
.(5)Cu2O的熔点比Cu2S的
高
高
(填“高”或“低”),请解释原因Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
Cu2O与Cu2S相比,阳离子相同、阴离子所带的电荷数也相同,但O2-半径比S2-半径小,所以Cu2O的晶格能更大,熔点更高
.锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
2Na3PO4+4CuSO4+2NH3?H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O
(1)写出基态Cu2+的核外电子排布式:
(2)PO43-的空间构型是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.N2H4分子中氮原子轨道的杂化类型是
(4)胆矾CuSO4?5H2O的结构示意图图1,其含有的微粒间作用力有
a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol CN-中含有的π键的数目为
(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图2所示.则该化合物的化学式为
查看习题详情和答案>>
2Na3PO4+4CuSO4+2NH3?H2O═Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O

(1)写出基态Cu2+的核外电子排布式:
[Ar]3d9
[Ar]3d9
.(2)PO43-的空间构型是
正四面体
正四面体
.(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.N2H4分子中氮原子轨道的杂化类型是
sp3
sp3
.(4)胆矾CuSO4?5H2O的结构示意图图1,其含有的微粒间作用力有
abde
abde
.(填序号)a.离子键 b.极性键 c.金属键 d.配位键 e.氢键 f.非极性键
(5)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则1mol CN-中含有的π键的数目为
2NA或2mol
2NA或2mol
.(6)Cu元素与H元素可形成一种红色化合物,其晶体结构单元如图2所示.则该化合物的化学式为
CuH
CuH
.硫元素可以形成多种物质如SCl
、SO2、SO
、SO
等.
(1)SCl
中S原子的轨道杂化类型是
的空间构型是
(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成.分析表明该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子和一种正四面体型的阳离子.
①[Cu(NH3)4]SO4中Cu2+的电子排布式为
②[Cu(NH33)4]SO4中存在的化学键类型有
A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
③写出与SO
互为等电子体的一种分子:
④上述白色沉淀的化学式为
查看习题详情和答案>>
+ 3 |
2- 3 |
2- 4 |
(1)SCl
+ 3 |
sp3
sp3
,SCl+ 3 |
三角锥型
三角锥型
.(2)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成.分析表明该沉淀中Cu、S、N的物质的量之比为1:1:1,经测定该沉淀的晶体里有一种三角锥型的阴离子和一种正四面体型的阳离子.
①[Cu(NH3)4]SO4中Cu2+的电子排布式为
[Ar]3d9
[Ar]3d9
.②[Cu(NH33)4]SO4中存在的化学键类型有
ACD
ACD
(填字母).A.共价键 B.氢键 C.离子键 D.配位键 E.分子间作用力
③写出与SO
2- 4 |
SiCl4或SiF4
SiCl4或SiF4
.④上述白色沉淀的化学式为
(NH4)CuSO3
(NH4)CuSO3
.锌是一种重要的金属,锌及其化合物有着广泛的应用.
①指出锌在周期表中的位置:第
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于

④如图2表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
查看习题详情和答案>>
①指出锌在周期表中的位置:第
四
四
周期,第IIB
IIB
族,属于ds
ds
区.②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂.写出Zn2+基态电子排布式
1s22s22p63s23p63d10或[Ar]3d10
1s22s22p63s23p63d10或[Ar]3d10
;葡萄糖分子中碳原子杂化方式有sp2、sp3
sp2、sp3
.③Zn2+能与NH3形成配离子[Zn(NH3)4]2+.配位体NH3分子属于
极性分子
极性分子
(填“极性分子”或“非极性分子”);在[Zn(NH3)4]2+中,Zn2+位于正四面体中心,N位于正四面体的顶点,试在图1中表示出[Zn(NH3)4]2+中Zn2+与N之间的化学键.
④如图2表示锌与某非金属元素X形成的化合物晶胞,其中Zn和X通过共价键结合,该化合物的化学式为
ZnX
ZnX
;该化合物晶体的熔点比干冰高
高
(填写“高”或“低”),原因是该化合物是原子晶体,而干冰是分子晶体
该化合物是原子晶体,而干冰是分子晶体
.不锈钢是由铁、铬、碳及众多不同元素所组成的合金,铁是主要成分元素,铬是第一主要的合金元素.其中铬的含量不能低于11%,不然就不能生成致密氧化膜CrO3防止腐蚀.
(1)写出Fe2+的基态离子的电子排布式: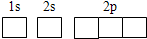

(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr的配位数为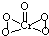
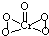 .
.
(3)H2O的分子构型为
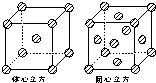
(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞与面心立方晶胞中实际含有的Fe原子个数之比为
查看习题详情和答案>>
(1)写出Fe2+的基态离子的电子排布式:
:[Ar]3d6或1s22s22p43s23p43d6
:[Ar]3d6或1s22s22p43s23p43d6
;基态碳(C)原子的电子排布图为

(2)[Cr(H2O)4Cl2]Cl?2H2O中Cr的配位数为
6
6
;已知CrO5中Cr为+6价,则CrO5的结构式为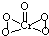
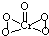
(3)H2O的分子构型为
V
V
;H2O分子间能形成氢键的原因是分子中有带孤电子对、电负性较强的氧原子,而且有一个与电负性较强的氧原子直接相连的氢原子
分子中有带孤电子对、电负性较强的氧原子,而且有一个与电负性较强的氧原子直接相连的氢原子
.(4)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示.体心立方晶胞与面心立方晶胞中实际含有的Fe原子个数之比为
1:2
1:2
.