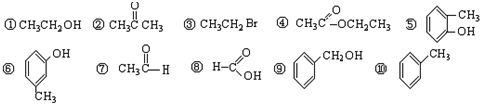
摘要:27.答案:(1)1s22s22p63s23p63d9. . Si<C<N. 原子晶体 [解析]先推导出元素是解题的前提:①29号为Cu.②Y价电子:msnmpn中n只能取2.又为短周期.则Y可能为C或Si.③R的核外L层为奇数.说明是第二周期的Li.B.N或F.④Q.X的p轨道为2和4.则Q为C或Si.X为O或S.再从五种元素原子序数依次递增.可推出:Q为6C.R为7N.X为8O.Y为14Si. (1)Cu的价电子排布为3d104s1.失去两个电子.则为3d9. (2)Cu2+可以与NH3形成配合物.其中NH3中N提供孤对电子.Cu提供空轨道.而形成配位键. (3)Q.Y的氢化物分别为CH4和SiH4.由于C的非金属性强于Si.则稳定性CH4>SiH4.因为SiH4的相对分子质量比CH4大.故分子间作用力大.沸点比CH4高. (4)C.N和Si中.C.Si位于同一主族.则上面的非金属性强.故第一电离能大.而N由于具有半充满状态.故第一电离能比相邻元素大.所以N>C>Si. (5)C.H形成的相对分子质量为26的物质为C2H2.结构式为H-C≡C-H.单键是σ键.叁键中有一个是σ键二个π键.所以σ键与π键数之比为3:2. (6)电负性最大的非元素是O.最小的非金属元素是Si.两者构成的SiO2.属于原子晶体.
网址:http://m.1010jiajiao.com/timu3_id_59570[举报]
下列原子或离子的电子排布式错误的是( )
A.Na+:1s22s22p6 B.O2-:1s22s22p4 C.F:1s22s22p5 D.Ne:1s22s22p6
【解析】考查核外电子的排布规律。根据构造原理可知选项ACD均正确。选项B中核外是10个电子,正确的应为1s22s22p6,所以答案选B。
查看习题详情和答案>>
下列原子或离子的电子排布式错误的是( )
A.Na+:1s22s22p6 B.O2-:1s22s22p4 C.F:1s22s22p5 D.Ne:1s22s22p6
【解析】考查核外电子的排布规律。根据构造原理可知选项ACD均正确。选项B中核外是10个电子,正确的应为1s22s22p6,所以答案选B。
查看习题详情和答案>>