摘要:34.联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热. (1)已知:2NO2(g)N2O4(g) DH =-57.20 kJ·mol-1.一定温度下.在密闭容器中反应2NO2(g)N2O4(g)达到平衡.其它条件不变时.下列措施能提高NO2转化率的是 . A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度 (2)25 ℃时.1.00 g N2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l).放出19.14 kJ的热量.则反应2N2H4(l)+N2O4(l) = 3N2(g)+4H2O(l)的DH = kJ·mol-1. (3)17 ℃.1.01×105 Pa.密闭容器中N2O4和NO2的混合气体达到平衡时.c(NO2) = 0.0300 mol·L-1.c(N2O4) = 0.0120 mol·L-1.计算反应2NO2(g)N2O4(g)的平衡常数K. (4)现用一定量的Cu与足量的浓HNO3反应.制得1.00 L已达到平衡的N2O4和NO2为混合气体(17 ℃.1.01×105 Pa).理论上至少需消耗Cu多少克? 高考真题答案与解析 化 学 [考点9] 化学反应速率与化学平衡
网址:http://m.1010jiajiao.com/timu3_id_59434[举报]
.联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
(1)已知:2NO2(g)?N2O4(g),N2O4为无色气体.
①在上述条件下反应能够自发进行,则反应的△H
②一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡,达到平衡状态的标志
A单位时间内生成n mol N2O4的同时生成2nmolNO2
B用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C混合气体的颜色不再改变的状态
D混合气体的密度不再改变的状态
E混合气体的平均相对分子质量不再改变的状态
③其他条件不变时,下列措施能提高NO2转化率的是
A 减小NO2的浓度 B 降低温度 C 增大压强 D 升高温度
④17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)=0.2mol?L-1、c(N2O4)=0.16mol?L-1.请计算反应初始时,充入NO2的物质的量;请计算该温度下该反应的平衡常数K;请计算该温度下反应N2O4(g)?2NO2(g)的平衡常数K.(请写出计算过程)
(2)25℃时,1molN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出612.5kJ的热量.
请写出该反应的化学方程式:
查看习题详情和答案>>
(1)已知:2NO2(g)?N2O4(g),N2O4为无色气体.
①在上述条件下反应能够自发进行,则反应的△H
<
<
0(填写“>”、“<”、“=”)②一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡,达到平衡状态的标志
ACE
ACE
.A单位时间内生成n mol N2O4的同时生成2nmolNO2
B用NO2、N2O4的物质的量浓度变化表示的反应速率之比为2:1的状态
C混合气体的颜色不再改变的状态
D混合气体的密度不再改变的状态
E混合气体的平均相对分子质量不再改变的状态
③其他条件不变时,下列措施能提高NO2转化率的是
BC
BC
(填字母)A 减小NO2的浓度 B 降低温度 C 增大压强 D 升高温度
④17℃、1.01×105Pa,往10L密闭容器中充入NO2,达到平衡时,c(NO2)=0.2mol?L-1、c(N2O4)=0.16mol?L-1.请计算反应初始时,充入NO2的物质的量;请计算该温度下该反应的平衡常数K;请计算该温度下反应N2O4(g)?2NO2(g)的平衡常数K.(请写出计算过程)
(2)25℃时,1molN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出612.5kJ的热量.
请写出该反应的化学方程式:
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225KJ/mol
2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)△H=-1225KJ/mol
. Ⅰ、利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中尾气处理装置略)的是
Ⅰ、利用下列各组物质制备和收集相应的气体,可采用如右下图所示装置(图中尾气处理装置略)的是①石灰石和稀盐酸 ②二氧化锰和浓盐酸
③铜和稀硝酸 ④铜和浓硫酸
⑤浓盐酸和浓硫酸 ⑥铝和烧碱溶液
Ⅱ、联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
(1)已知:2NO2(g)?N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=
Ⅲ、镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O
| 放电 | 充电 |
(3)该电池充电时阳极反应式:
(4)放电时负极附近溶液的碱性
联氨(N2H4)及其衍生物是一类重要的火箭燃料,N2H4与N2O4反应能放出大量的热.
(1)已知:2NO2(g?N2O4(g);△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2的转化率的是
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00g N2H4与足量N2O4完全反应生成N2(g)和H2O,放出19.14kJ的热量.则反应:
2N2H4+N2O4═3N2(g)+4H2O的△H=-1224.96
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030 0mol?L-1、c(N2O4)=0.012 0mol?L-1.计算反应2NO2(g?N2O4(g)的平衡常数K.
(4)现用一定量的Cu与足量的浓HNO3反应,制得上述1.00L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
查看习题详情和答案>>
(1)已知:2NO2(g?N2O4(g);△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2的转化率的是
BC
BC
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00g N2H4与足量N2O4完全反应生成N2(g)和H2O,放出19.14kJ的热量.则反应:
2N2H4+N2O4═3N2(g)+4H2O的△H=-1224.96
-1224.96
-1224.96
kJ?mol-1.(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.030 0mol?L-1、c(N2O4)=0.012 0mol?L-1.计算反应2NO2(g?N2O4(g)的平衡常数K.
(4)现用一定量的Cu与足量的浓HNO3反应,制得上述1.00L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
(2009?江苏)联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
(1)已知:2NO2(g)═N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)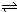 N2O4(g)达到平衡.
N2O4(g)达到平衡.
其他条件不变时,下列措施能提高NO2转化率的是
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=
(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol?L-1、c(N2O4)=0.0120mol?L-1.计算反应2NO2(g)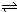 N2O4(g)的平衡常数K.
N2O4(g)的平衡常数K.
(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
查看习题详情和答案>>
(1)已知:2NO2(g)═N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)
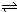 N2O4(g)达到平衡.
N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是
BC
BC
(填字幕)A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=
-1224.96
-1224.96
kJ?mol-1(3)17℃、1.01×105Pa,密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.0300mol?L-1、c(N2O4)=0.0120mol?L-1.计算反应2NO2(g)
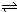 N2O4(g)的平衡常数K.
N2O4(g)的平衡常数K.(4)现用一定量的Cu与足量的浓HNO3反应,制得1.00L已达到平衡的N2O4和NO2的混合气体(17℃、1.01×105Pa),理论上至少需消耗Cu多少克?
联氨(N2H4)及其衍生物是一类重要的火箭燃料.N2H4与N2O4反应能放出大量的热.
(1)已知:2NO2(g)?N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=
(3)17℃、1.01×105Pa,10L密闭容器中N2O4和NO2的混合气体达到平衡时,n(NO2)=0.300mol、n(N2O4)=0.120mol.计算该条件下反应2NO2(g)?N2O4(g)的平衡常数K.(要求:①写出计算过程;②注明K的单位)
查看习题详情和答案>>
(1)已知:2NO2(g)?N2O4(g)△H=-57.20kJ?mol-1.一定温度下,在密闭容器中反应2NO2(g)?N2O4(g)达到平衡.其他条件不变时,下列措施能提高NO2转化率的是
BC
BC
(填字母编号)A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
(2)25℃时,1.00gN2H4(l)与足量N2O4(l)完全反应生成N2(g)和H2O(l),放出19.14kJ的热量.则反应2N2H4(l)+N2O4(l)=3N2(g)+4H2O(l)的△H=
-1224.96
-1224.96
kJ?mol-1(3)17℃、1.01×105Pa,10L密闭容器中N2O4和NO2的混合气体达到平衡时,n(NO2)=0.300mol、n(N2O4)=0.120mol.计算该条件下反应2NO2(g)?N2O4(g)的平衡常数K.(要求:①写出计算过程;②注明K的单位)