摘要:12.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料.其煅烧产物为SO2和Fe3O4. (1)将0.50molSO2(g)和0.030molO2(g)放 入容积为1L的密闭容器中.反应 2SO2(g) +O2(g) 2SO3(g) 在一定条件下达到平衡.测得 c(SO3)=0.040mol·L-1.计算该条件下反应的平衡常数K 和SO2的平衡转化率 (2)已知上述反应是放热反应.当该反应处于平衡状态时.在体积不变的条件下.下列措施中有利于提高SO2平衡转化的有 . A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出氧气 (3)SO2尾气用饱和Na2SO4溶液吸收可得到重要化工原料.反应的化学方程式为: . (4)将黄铁矿的燃烧产物Fe3O4溶液于H2SO4后.加入铁粉.可制备FeSO4.酸溶过程中需保持溶液足够酸性.其原因是 .
网址:http://m.1010jiajiao.com/timu3_id_59412[举报]
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其步骤为:第一步,煅烧FeS2产物为SO2和Fe3O4;第二步,SO2向SO3的转化;第三步,SO3转化为硫酸.
(1)在恒温条件下,向一固定容积的密闭容器中通入一定量的SO2与O2,发生如下反应2SO2(g)+O2(g)?2SO3(g),一段时间后,能说明该反应达到平衡状态的有
a.SO2和SO3浓度相等 b.SO2百分含量保持不变c.容器中气体的压强不变
d.SO3的生成速率与SO2的生成速率相等 e.容器中混合气体的密度保持不变
(2)SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为
(3)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其目的是
(4)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol?L.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程).
查看习题详情和答案>>
(1)在恒温条件下,向一固定容积的密闭容器中通入一定量的SO2与O2,发生如下反应2SO2(g)+O2(g)?2SO3(g),一段时间后,能说明该反应达到平衡状态的有
bcd
bcd
a.SO2和SO3浓度相等 b.SO2百分含量保持不变c.容器中气体的压强不变
d.SO3的生成速率与SO2的生成速率相等 e.容器中混合气体的密度保持不变
(2)SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为
SO2+H2O+2NH3=(NH4)2SO3
SO2+H2O+2NH3=(NH4)2SO3
;(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
(3)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其目的是
抑制Fe2+、Fe3+的水解,防止Fe2+被氧化;
抑制Fe2+、Fe3+的水解,防止Fe2+被氧化;
.(4)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol?L.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程).
1.6×103L/mol;80%
1.6×103L/mol;80%
.黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3.
(1)450℃时,将0.050mol SO2和0.030mol O2放入容积为1L的密闭容器中反应,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,放出3.932KJ的热量,则该条件下反应的平衡常数K为
(2)SO2的平衡转化率为
查看习题详情和答案>>
(1)450℃时,将0.050mol SO2和0.030mol O2放入容积为1L的密闭容器中反应,在一定条件下达到平衡,测得c(SO3)=0.040mol/L,放出3.932KJ的热量,则该条件下反应的平衡常数K为
1.6×103
1.6×103
;升高温度,该平衡常数减小
减小
(填“增大”或“减小”).(2)SO2的平衡转化率为
80%
80%
;写出该反应的热化学方程式2SO2(g)+O2(g)?2SO3(g))△H=-196.6kJ?mol-1
2SO2(g)+O2(g)?2SO3(g))△H=-196.6kJ?mol-1
. 黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3.
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe2O3.(1)将0.050mol SO2(g)和0.030mol O2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol?L-1.计算该条件下反应的平衡常数K和SO2的平衡转化率
1.6×103
1.6×103
、80%
80%
(写出计算过程).(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有
B
B
(填字母序号,多选倒扣分).A.升高温度 B.降低温度 C.增大压强 D.加入催化剂 E.移出氧气
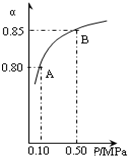
(3)某温度下,上述反应中SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示.判断:平衡状态由A变到B时,平衡常数K(A)
=
=
K(B)(填“>”、“<”或“=”).黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其燃烧产物为SO2和Fe2O3.
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L.则该条件下反应的平衡常数K的数值为
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改变反应的催化剂 D.降低反应的温度
(4)反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图.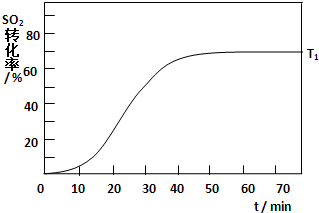
查看习题详情和答案>>
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
4FeS2(s)+11O2(g)
2Fe2O3(s)+8SO2(g)△H=-3408kJ/mol
| ||
4FeS2(s)+11O2(g)
2Fe2O3(s)+8SO2(g)△H=-3408kJ/mol
.
| ||
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L.则该条件下反应的平衡常数K的数值为
1.6×103
1.6×103
,SO2的平衡转化率为80%
80%
.(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是
B
B
.(填字母)A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改变反应的催化剂 D.降低反应的温度
(4)反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图.

黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。(1)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)![]() 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L。计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有 (填字母)
A 升高温度 B 降低温度 C 增大压强
D 减小压强 E 加入催化剂 G 移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为
。
(4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是 。
[思路分析] 本试题考查“起”、“转”、“平”三步骤计算方法和平衡常数计算方法。
查看习题详情和答案>>