题目内容
(1)已知1g FeS2完全燃烧放出7.1kJ热量,则表示FeS2完全燃烧反应的热化学方程式为:
| ||
| ||
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L.则该条件下反应的平衡常数K的数值为
(3)当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.改变反应的催化剂 D.降低反应的温度
(4)反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,请在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图.

(2)依据化学平衡三段式和平衡常数、转化率概念列式计算;
(3)欲使平衡向正反应方向移动且反应速率加快改变的条件需要增大反应物的浓度、增大压强等措施;注意温度降低平衡正向进行,但速率减小;
(4)反应是放热反应,温度升高,平衡逆向进行二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线;
4FeS2(s)+11O2(g)
| ||
故答案为:4FeS2(s)+11O2(g)
| ||
(2)将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g)?2SO3(g) 在一定条件下达到平衡,测得c(SO3)=0.040mol/L.依据平衡三段式列式计算;
2SO2(g)+O2(g)?2SO3(g)
起始量(mol/L) 0.05 0.03 0
变化量(mol/L) 0.04 0.02 0.04
平衡量(mol/L)0.01 0.01 0.04
平衡常数=
| 0.042 |
| 0.012×0,01 |
SO2的平衡转化率=
| 0.04mol/L |
| 0.05mol/L |
故答案为:1.6×103;80%;
(3)欲使平衡向正反应方向移动且反应速率加快;
A.向平衡混合物中充入Ar,容器中总压增加,分压不变,平衡不动,故A不符合;
B.向平衡混合物中充入O2,增大反应物的浓度平衡正向进行,反应速率增大,故B符合;
C.改变反应的催化剂,对平衡无影响,平衡不动,故C不符合;
D.降低反应的温度,反应速率减小,故D不符合;
故答案为:B;
(4)反应:2SO2(g)+O2(g)?2SO3(g)△H<0,SO2的转化率在起始温度T1=673K下随反应时间(t)的变化如下图,其他条件不变,仅改变起始温度为T2=723K,温度升高,平衡逆向进行,二氧化硫的转化率减小,但反应速率增大,达到平衡需要的时间短,在图中画出温度T2下SO2的转化率随反应时间变化的预期结果示意图如图所示;
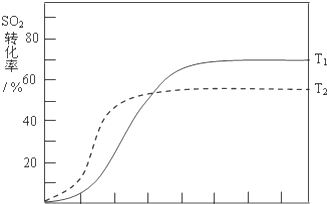
故答案为:


| |||||||||||||||||||
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称 |
溶度积(Ksp) |
pH值 |
|
|
开始沉淀 |
完全沉淀 |
||
|
Mg(OH)2 |
5.6×10-12 |
9.3 |
10.8 |
|
Fe(OH)3 |
2.8×10-16 |
2.7 |
3.7 |
|
Al(OH)3 |
1.3×10-33 |
3.7 |
4.7 |
请回答下列问题:
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。