摘要:25g x = ∴ x=4.8g 答:加热12.25gKClO3.可制得O24.8g. 例3 把干燥纯净的KClO3和MnO2的混合物13.32克.加热至不再产生气体为止.称量剩余物质量为9.48克.求①生成氧气的质量,②剩余物质各是什么?质量分别是多少克? 分析 MnO2作为催化剂在反应前后其质量和化学性质都不改变.所以13.32g-9.48g=3.84g, 这3.84g就是放出O2的质量.这也是解本题的关键. 解 根据质量守恒定律 mO2 = 13.32g – 9.48g = 3.84g 设生成物中KCl质量为xg 2KClO3 2KCl + 3O2↑ 149 96 x 3.84g = ∴ x=5.96g MnO2的质量 9.48g – 5.96g = 3.52g 答:氧气的质量为3.84g.剩余物为KCl和MnO2质量分别为5.96g和3.52g. 例4 在标准状况下.6.2g磷在氧气中充分燃烧.需要氧气多少克?这些氧气的体积是多少升?能生成P2O5多少克?(已知标况下O2=1.43g/L) 分析 根据化学方程式的计算要求单位一致.初中阶段只涉及反应物和生成物的质量比计算.所以本题不能直接求出O2的体积.只能先求出生成O2的质量.再根据V气 = 进行换算. 解 设需要氧气的质量为x.生成P2O5的质量为y. 4P + 5O2 2P2O5 4×31 5×32 2×142
网址:http://m.1010jiajiao.com/timu3_id_5813[举报]
如图是a、b、c三种物质的溶解度曲线,a与c的溶解度曲线相交于P点.据图回答: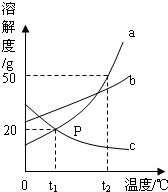
(1)P点的含义是______;
(2)t2℃时25g a物质加入到50g水中不断搅拌,能形成75g饱和溶液吗?______(填写“能”或“不能”);
(3)t2℃时,将等质量的a、b、c三种物质分别放入100g水中充分溶解,只得到一杯饱和溶液,则它是______(填a、b、c)的饱和溶液;
(4)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是______(填写选项序号).
A.c>a=b B.a=b>c C.b>a>c D.a>b>c.
查看习题详情和答案>>
对牙膏的探究要用到许多化学知识。
(1)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,某实验小组同学设计了2种转化流程,如下图1所示.

请回答下列问题:
a.小王同学主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单。
请写出反应①和④的化学方程式:① ;④ ;
b.操作Ⅱ包括搅拌、 、洗涤、干燥等工序。
c.小李同学认为流程①、②、③和操作I比小王的主张更好,其理由是: ;
操作I包括搅拌和微热等工序。
(2)该实验小组为了测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图2所示,请完成下列计算内容:
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?
(1)用作牙膏摩擦剂的轻质碳酸钙,工业上常用石灰石来制备,某实验小组同学设计了2种转化流程,如下图1所示.

请回答下列问题:
a.小王同学主张用流程①、②、④和操作Ⅱ的设计,认为其工艺简单。
请写出反应①和④的化学方程式:① ;④ ;
b.操作Ⅱ包括搅拌、 、洗涤、干燥等工序。
c.小李同学认为流程①、②、③和操作I比小王的主张更好,其理由是: ;
操作I包括搅拌和微热等工序。
(2)该实验小组为了测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应)。随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图2所示,请完成下列计算内容:
①样品中碳酸钙的质量分数是多少?
②所用稀盐酸溶质的质量分数是多少?