摘要:现有A.B.C.D.E五种物质的水溶液.它们的溶质分别由SO42-.NO3-.Cl-.OH-.CO32-和Ba2+.Ag+.Fe3+.Na+.Al3+中的两种离子组成.且任何两种物质都不含有相同的离子.相关的实验如下: ①用pH试纸测定.只有A.E的溶液显碱性.且A.E的溶液pH均为11, ②将纯净铁粉加入到C溶液中.过滤后.称得溶液质量增加.溶液的颜色也有明显的变化, ③分别加BaCl2溶液于B和D的溶液中.只有D溶液中产生白色沉淀.该沉淀不溶于稀HNO3, ⑴写出下列物质的化学式:B: C: D: ⑵通过上述实验还不确定A和E的组成.现只有蒸馏水.pH试纸.量筒等实验用品.请设计确定E组成的补充操作: .
网址:http://m.1010jiajiao.com/timu3_id_58044[举报]
现有A、B、C、D、E五种物质,它们的焰色反应都显黄色,它们还能发生如下反应:
①A+Q → C+X↑
②B+Q → C+Y↑
③E → D+Z↑+Q
④X+Y → Q
已知:气体X有还原性;气体Y有氧化性;无味气体Z能使石灰水变浑浊;Q在常压下、100 ℃时发生沸腾。
(1)写出下列物质的化学式:A_________,B________,C_________,D_________。
(2)反应②的离子方程式为______________________。
(3)写出铝与C的溶液反应的离子方程式:______________________。
查看习题详情和答案>>
①A+Q → C+X↑
②B+Q → C+Y↑
③E → D+Z↑+Q
④X+Y → Q
已知:气体X有还原性;气体Y有氧化性;无味气体Z能使石灰水变浑浊;Q在常压下、100 ℃时发生沸腾。
(1)写出下列物质的化学式:A_________,B________,C_________,D_________。
(2)反应②的离子方程式为______________________。
(3)写出铝与C的溶液反应的离子方程式:______________________。
现有A、B、C、D、E五种元素,它们的质子数依次增多.
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
(1)写出元素C、E的名称:C
(2)画出A的原子结构示意图
 ,B的离子结构示意图
,B的离子结构示意图
 ,D的单质分子的电子式
,D的单质分子的电子式
 .
.
(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:
(5)写出E与冷水反应的化学方程式:
查看习题详情和答案>>
①A的核电荷数大于2,可形成氢化物H2A,该氢化物在常温下是液体;
②A和B两元素可形成B2A3化合物,该化合物既能溶于强酸,又能溶于强碱;
③C+离子比B3+离子多8个电子;
④C与D元素可以形成化合物CD;
⑤CD的溶液中通入氯气后加淀粉溶液显蓝色;
⑥E、C同主族,且E比C多两个电子层,E单质可与冷水反应生成氢气.
试回答:
(1)写出元素C、E的名称:C
钾
钾
;E铯
铯
.(2)画出A的原子结构示意图






(3)写出B2A3分别与盐酸和氢氧化钠溶液反应的离子方程式:
Al2O3+6H+=2Al3++3H2O
Al2O3+6H+=2Al3++3H2O
;Al2O3+2OH-=2AlO2-+H2O
Al2O3+2OH-=2AlO2-+H2O
.(4)比较B、C、E三种元素形成的简单离子半径的大小和氧化性的强弱(用离子符号表示):离子半径:
Cs+>K+>Al3+
Cs+>K+>Al3+
;氧化性:Al3+>K+>Cs+
Al3+>K+>Cs+
.(5)写出E与冷水反应的化学方程式:
2Cs+2H2O=2CsOH+H2↑
2Cs+2H2O=2CsOH+H2↑
.现有A、B、C、D、E五种可溶性强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性;
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)写出A溶液与E溶液反应的化学方程式:
(2)写出E溶液与过量的B溶液反应的离子方程式:
(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l)△H=-akJ?mol-1.请写出B与C的稀溶液反应的热化学方程式:
查看习题详情和答案>>
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生;
③D溶液与另外四种溶液反应都能产生沉淀;C只能与D反应产生沉淀;
④上述沉淀包括难溶物和微溶物.
试回答下列问题:
(1)写出A溶液与E溶液反应的化学方程式:
3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4
3Na2CO3+Al2(SO4)3+3H2O=2Al(OH)3↓+3CO2↑+3Na2SO4
.(2)写出E溶液与过量的B溶液反应的离子方程式:
2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O
2A13++3SO42-+3Ba2++8OH-=2A1O2-+3BaSO4↓+4H2O
.(3)已知:NaOH(aq)+HNO3(aq)=NaNO3(aq)+H2O(l)△H=-akJ?mol-1.请写出B与C的稀溶液反应的热化学方程式:
OH-(aq)+H+(aq)=H2O(1)△H=-akJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-akJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol
OH-(aq)+H+(aq)=H2O(1)△H=-akJ/mol或1/2Ba(OH)2(aq)+HC1(aq)=1/2BaC12(aq)+H2O(1)△H=-akJ/mol
或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol
.或Ba(OH)2(aq)+2HC1(aq)=BaC12(aq)+2H2O(1)△H=-2akJ/mol
现有A、B、C、D、E五种强电解质,它们在水中可电离产生下列离子(各种离子不重复).
已知:①A、B两溶液呈碱性;C、D、E溶液呈酸性.
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应均能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)A、B、C、D、E的化学式分别为 、 、 、 、 ;
(2)常温下,浓度均为0.1mol?L-1的A、B溶液中H2O的电离程度的关系是A B(填“<”、“>”或“=”);
(3)在100mL 0.1mol?L-1 E溶液中,逐滴加入35mL,2mol?L-1NaOH溶液,最终得到沉淀的物质的量为 mol.
查看习题详情和答案>>
| 阳离子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 阴离子 | OH-、Cl-、CO32-、NO3-、SO42- |
②A溶液与E溶液反应既有气体又有沉淀产生;A溶液与C溶液反应只有气体产生(沉淀包括微溶物,下同).
③D溶液与另外四种溶液反应均能产生沉淀;C只能与D反应产生沉淀.
试回答下列问题:
(1)A、B、C、D、E的化学式分别为
(2)常温下,浓度均为0.1mol?L-1的A、B溶液中H2O的电离程度的关系是A
(3)在100mL 0.1mol?L-1 E溶液中,逐滴加入35mL,2mol?L-1NaOH溶液,最终得到沉淀的物质的量为
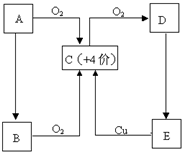 A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.
A、B、C、D、E五种物质有如图所示的转化关系,且物质A是一种淡黄色的固体.(1)写出A、C、E物质的化学式.
A
(2)试管壁上如果沾有A,应用
(3)对于C:
①将C分别通入下列溶液时有何现象,并说明产生这种现象的原因.
A.澄清石灰水:现象
原因
B.品红溶液:现象
原因
②若将C和氯气等体积混合,然后通入品红溶液,现象与①有何不同
(4)浓的E溶液在常温下为粘稠的液体,且E具有强吸水性、强氧化性、强脱水性.则
①E表现吸水性时,可做干燥剂,下列物质可用E干燥的是
A.氨气 B.硫化氢C.氢气 D.二氧化硫
②浓E溶液与铜反应时,E除了表现强氧化性外,还表现了