摘要:17.现有如下药品和装置:w克锌片.稀H2SO4.水.设计一个实验.测Zn的相对原子质量(假定实验是在标准状况下进行的). (1)写出该反应的化学方程式 , (2)所用装置的连接顺序为 (3)实验时用稀硫酸而不用稀硝酸.其理由是 , (4)若量筒中收集到的水为V mL.反应时加入的稀硫酸为10 mL.实验结束后导管内的水按1 mL计算.则反应产生的氢气为 mL.Zn的相对原子质量的数学表达式为 , (5)假如锌片含不与酸反应的杂质.实验测得的锌的相对原子质量可能比真实值(填“偏大 .“偏小 .“不影响 .下同) ,若气密性不好.测得值 ,Zn与稀H2SO4的反应是放热的.若立即读数.会使测定的结果 .
网址:http://m.1010jiajiao.com/timu3_id_57963[举报]
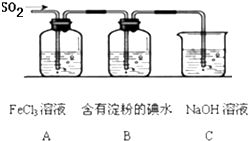 某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如图所示:(1)下列实验方案适用于在实验室制取所需SO2的是
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.碳与热浓H2SO4
(2)装置C的作用是
(3)写出SO2气体通入A中的离子反应方程式
(4)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,取A中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红
上述方案不合理的是
(5)能表明I-的还原性弱于SO2的现象是
(2013?南昌三模)某兴趣小组挤究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:
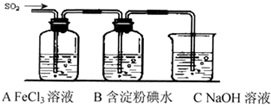
(1)SO2气体还原Fe3+反应的产物是
(2)下列实验方案可以用于在实验室制取所需SO2的是
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸 C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为
(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案@:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是
(6)能表明I-的还原性弱于SO2的现象是
查看习题详情和答案>>

(1)SO2气体还原Fe3+反应的产物是
Fe2+
Fe2+
、SO42-
SO42-
(填离子符号).(2)下列实验方案可以用于在实验室制取所需SO2的是
BD
BD
.A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸 C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
除去多余的SO2,防止污染空气
除去多余的SO2,防止污染空气
.(4)如果有280mL SO2气体(已折算为标态)进入C装置中,则C中,50mL NaOH溶液的浓度至少为
0.25
0.25
mol/L才能达到目的.(5)在上述装置中通入过量的SO2为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案@:往第一份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第二份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的是
①
①
,原因是SO2、Fe2+都能使酸性高锰酸钾褪色
SO2、Fe2+都能使酸性高锰酸钾褪色
.(6)能表明I-的还原性弱于SO2的现象是
B中蓝色褪去
B中蓝色褪去
,写出有关离子方程式:I2+SO2+2H2O→4H++2I-+SO42-
I2+SO2+2H2O→4H++2I-+SO42-
.某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示:

(1)SO2气体还原Fe3+生成的还原产物是
(2)下列实验方案适用于在实验室制取所需SO2的是
A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有
A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的一个是
(6)上述装置中能表明I-的还原性弱于SO2的现象是
查看习题详情和答案>>

(1)SO2气体还原Fe3+生成的还原产物是
Fe2+
Fe2+
(填离子符号),参加反应的SO2和Fe3+的物质的量之比是1:2
1:2
.(2)下列实验方案适用于在实验室制取所需SO2的是
BD
BD
(双选,填序号).A.Na2SO3溶液与HNO3 B.Na2SO3固体与浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热浓H2SO4
(3)装置C的作用是
吸收SO2尾气,防止污染空气
吸收SO2尾气,防止污染空气
.(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、过滤、自然干燥,在这一系列操作中没有用到的仪器有
AB
AB
(双选,填序号).A.蒸发皿 B.石棉网 C.漏斗 D.烧杯 E.玻璃棒 F.坩埚
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入KMnO4溶液,紫红色褪去.
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红.
方案③:往第三份试液加入用稀盐酸酸化的BaCl2,产生白色沉淀.
上述方案不合理的一个是
方案①
方案①
,原因是因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色
因为A的溶液中含有SO2,SO2也能使KMnO4溶液褪色
.(6)上述装置中能表明I-的还原性弱于SO2的现象是
B中蓝色溶液褪色
B中蓝色溶液褪色
.氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域.在氮气流中由氧化铝与焦炭在电炉中加热制得.原料配比不当或反应不完全等因素都会造成产品中含有碳、Al4C3或Al2O3等杂质.回答下列问题:
(1)反应Al2O3+N2+3C
2AlN+3CO中,氧化剂是
(2)探究氮化铝与酸的反应,并检验生成产物中含有NH4+.请完成下列实验步骤.
步骤1:取少量样品于试管中,滴加稀H2SO4至溶液呈酸性
步骤2: .
(3)AlN也可以与强碱溶液反应.完成下列方程式:
AlN+NaOH+H2O= +
(4)Al 4C3与水反应生成甲烷,甲烷与CuO反应的化学方程式如下:
CH4+4CuO
CO2+2H2O+4Cu 测定产品中有关成分的含量,所需仪器如下:

Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接的顺序为A→C→F→C→D→E.主要实验步骤如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
③点燃F酒精灯
④缓缓鼓入一定量的N2
⑤再次缓缓鼓入一定量的N2
⑥再次称量D的质量
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
操作的先后顺序是①→ →⑤→⑥→⑦,操作④的目的是 .
Ⅱ.为测定AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
→ → →E,试样为mg,测得C增重n g,则AlN的质量分数是 .
查看习题详情和答案>>
(1)反应Al2O3+N2+3C
| ||
(2)探究氮化铝与酸的反应,并检验生成产物中含有NH4+.请完成下列实验步骤.
步骤1:取少量样品于试管中,滴加稀H2SO4至溶液呈酸性
步骤2:
(3)AlN也可以与强碱溶液反应.完成下列方程式:
AlN+NaOH+H2O=
(4)Al 4C3与水反应生成甲烷,甲烷与CuO反应的化学方程式如下:
CH4+4CuO
| ||

Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接的顺序为A→C→F→C→D→E.主要实验步骤如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
③点燃F酒精灯
④缓缓鼓入一定量的N2
⑤再次缓缓鼓入一定量的N2
⑥再次称量D的质量
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
操作的先后顺序是①→
Ⅱ.为测定AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
(2011?扬州三模)氮化铝(AlN)是一种新型的无机非金属材料,工业上由氧化铝与焦炭在氮气流中高温制得.请回答下列有关问题.
(1)氮化铝(AlN)制备:Al2O3+N2+3C
2AlN+3CO,反应中氧化产物与还原产物的物质的量之比为
(2)AlN产品中常含有Al4C3、碳和Al2O3等杂质,已知Al4C3与水反应生成CH4,CH4与CuO发生反应:CH4+4CuO
CO2+2H2O+4Cu.为测定产品中有关成分的含量,所需仪器如下:

若各装置连接的顺序为:A→C→F→C→D→E,请补充操作步骤:
①称量D的质量,按顺序组装仪器,检查装置的气密性,将试样放入锥形瓶中;
②
⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
已知AlN能够水解.请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
×100%
×100%.
查看习题详情和答案>>
(1)氮化铝(AlN)制备:Al2O3+N2+3C
| ||
3:2
3:2
.(2)AlN产品中常含有Al4C3、碳和Al2O3等杂质,已知Al4C3与水反应生成CH4,CH4与CuO发生反应:CH4+4CuO
| ||

若各装置连接的顺序为:A→C→F→C→D→E,请补充操作步骤:
①称量D的质量,按顺序组装仪器,检查装置的气密性,将试样放入锥形瓶中;
②
缓缓鼓入一定量的N2
缓缓鼓入一定量的N2
;③_______;④从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止
;⑤再次缓缓鼓入一定量的N2
再次缓缓鼓入一定量的N2
;⑥再次称量D的质量;⑦重复步骤⑤和⑥的操作,直到D的质量基本不变
已知AlN能够水解.请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
B
B
→D
D
→C
C
→E.若试样为mg,测得C增重ng,则AlN的质量分数是| 41n |
| 17m |
| 41n |
| 17m |