摘要:C 2.B 3.B
网址:http://m.1010jiajiao.com/timu3_id_57792[举报]
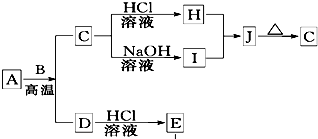 B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.
B、D是常见金属单质,A是一种红棕色金属氧化物,电解熔融态的C得到B单质,J是一种难溶于水的白色固体.(1)在E的溶液中加入氢氧化钠溶液,可以观察到的现象是
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
先生成白色沉淀,迅速变为灰绿色,最终变为红褐色
.(2)按要求写化学方程式或离子方程式:
①A与B在高温条件下生成C和D的化学方程式:
Fe2O3+2Al
Al2O3+2Fe
| ||
Fe2O3+2Al
Al2O3+2Fe
;
| ||
②在E的水溶液中通入氯气后的生成物和I溶液反应的离子方程式:
Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓
Fe3++3AlO2-+6H2O═3Al(OH)3↓+Fe(OH)3↓
.(3)由D和A组成的混合物与稀HCl作用,固体恰好溶解,所得溶液中滴加KSCN溶液不显红色,且生成的E与H2的物质的量之比为4:1.则反应物中A、D、HCl的物质的量之比为
1:2:8
1:2:8
.C和Si元素在化学中占有极其重要的地位.
(1)写出Si的基态原子核外电子排布式
(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
(3)氧化物MO的电子总数与SiC的相等,则M为
(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健
(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子.则可推出:A的电子式是
 ,B的结构式是
,B的结构式是
(6)已知Si-Si键能为176kJ/mol,Si-O键能为460kJ/mol,O=O键能为497.3kJ/mol.则可计算出1mol硅与足量氧气反应时将放出
查看习题详情和答案>>
(1)写出Si的基态原子核外电子排布式
1s22s22p63s23p2
1s22s22p63s23p2
.从电负性角度分析,C、Si和O元素的非金属活泼性由强至弱的顺序为O>C>Si
O>C>Si
.(2)SiC的晶体结构与晶体硅的相似,其中C原子的杂化方式为
sp3
sp3
,微粒间存在的作用力是共价键
共价键
.(3)氧化物MO的电子总数与SiC的相等,则M为
Mg
Mg
(填元素符号),MO是优良的耐高温材料,其晶体结构与NaCl晶体相似,MO的熔点比CaO的高,其原因是Ca2+的离子半径大于Mg2+,MgO的晶格能大
Ca2+的离子半径大于Mg2+,MgO的晶格能大
.(4)C、Si为同一主族的元素,CO2和SiO2化学式相似,但结构和性质有很大不同.CO2中C与O原子间形成σ键和π键,SiO2中Si与O原子间不形成上述π健.从原子半径大小的角度分析,为何C、O原子间能形成,而Si、O原子间不能形成上述π健
Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
Si、O原子间距离较大,p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π键
.(5)有A、B、C三种物质,每个分子中都各有14个电子,其中A的分子属于非极性分子,且只有非极性键;B的分子也属于非极性分子,但既有非极性键,又有极性键;C的分子属于极性分子.则可推出:A的电子式是


H-C≡C-H
H-C≡C-H
.(6)已知Si-Si键能为176kJ/mol,Si-O键能为460kJ/mol,O=O键能为497.3kJ/mol.则可计算出1mol硅与足量氧气反应时将放出
=-990.7
=-990.7
kJ的热量.