网址:http://m.1010jiajiao.com/timu3_id_57621[举报]
(1)B在周期表中位于第
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分.现取13.0g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6.72L)和一种固体单质,则乙的化学式是
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物.汽车内燃机工作时引起反应:C2(g)+D2(g)?2CD(g),是导致汽车尾气中含有CD的原因之一.T℃时,向容积为2L的密闭容器中充入10molC2与5molD2,达到平衡后CD的物质的量为2mol,则T℃时该反应的平衡常数K=
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染.
已知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ?mol-1
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2(g)△H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H3=-867kJ?mol-1
△H2=
请完成下列问题:
(1)由A、B、C、D四种元素组成的酸式盐,在加热条件下发生的反应为____________。
(2)单质A和单质C在一定的条件下可生成化合物E,该反应的化学方程式为________________________;E晶体的空间构型为____________。
(3)4 g B单质在足量的D单质中完全燃烧放热131.17 kJ,试写出该反应的热化学方程式:____________________________________。
(4)在一定的温度下,向一个体积为2 L的密闭容器中通入2 mol单质A和8 mol C单质,3 min时达到平衡,测得E的浓度为1 mol·L-1,该时间内C的化学反应速率为____________。
(5)化合物CD与D2单质发生的反应为:2CD(g)+D2(g) ![]() 2CD2(g),现在一定温度下,在一个固定体积的密闭容器中,充入2 mol CD(g)和1 mol D2(g),在一定条件下达成平衡,测得CD的转化率为80%(容器内温度不变),此时,容器内的压强与起始压强之比小于_____________(填比值)。
2CD2(g),现在一定温度下,在一个固定体积的密闭容器中,充入2 mol CD(g)和1 mol D2(g),在一定条件下达成平衡,测得CD的转化率为80%(容器内温度不变),此时,容器内的压强与起始压强之比小于_____________(填比值)。
(1)A、B、C、D四种元素组成的化合物中既能与盐酸反应,又能与NaOH反应的相对分子质量最小的化合物的结构简式为? ?,A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式? ?,其水溶液的pH? ?7(填“>”“<”或“=”)。
(2)将ACD3的稀溶液和CA3的水溶液混合,不可能出现的结果是(填字母)? ?。?
a.pH<7,且c(H+)>c(CD-3)>c(OH-)>c(CA+4)?
b.pH<7,且c(CD-3)>c(OH-)=c(H+)>c(CA+4)
c.pH>7,且c(CA+4)>c(OH-)>c(CD-3)>c(H+)?
d.pH=7,且c(CA+4)>c(CD-3)>c(H+)>c(OH- )?
(3)A、D、E与氯四种元素中的三种组成化合物X、Y,组成元素原子个数比为1∶1∶1,其水溶液的酸碱性与CA3水溶液的相同;常温下0.1 mol·L-1?的X溶液的pH与0.1 mol·L-1?盐酸的pH之和为14;则X、Y的化学式为X ,Y 。?
(4)常温下,0.01 mol·L-1X的溶液中,水电离产生的OH-的物质的量浓度为? ? mol·L-1;相同pH的X、Y溶液,加水稀释相同倍数后,溶液的pH分别为a1、a2,则a1 a2(填“>”“<”或“=”)。?
(5)“神舟”六号发射时所用火箭推进器中盛有液态的C2A4和液态A2D2,当它们混合时,即产生大量的N2和水蒸气,并放出大量的热。已知0.4 mo1 C2A4与一定量液态A2D2发生上述反应,可放出256.6 kJ的热量,则上述反应的热化学方程式为 。?
查看习题详情和答案>>(14分)A、B、C、D、E、F是原子序数依次增大的六种短周期元素。F的单质在D2中燃烧的产物可使品红溶液褪色;B的单质在D2中燃烧可生成BD和BD2两种气体;E的原子序数为B的两倍;A元素的一种核素中不含中子。请回答下列问题:
(1)C的单质分子的结构式为 ;ED的电子式为 。
(2)E单质在BD2中剧烈燃烧生成黑白两种固体,该反应的化学方程式为 。
(3)FD2气体通入BaCl2和HNO3的混合溶液中,生成白色沉淀和无色气体CD,有关反应的离子方程式为 ,由此可知CD和FD2中还原性较强的是 (填化学式)。
(4)A、C、D、F四种元素按原子个数比为5 :1 :4 :1形成化合物甲,则甲的化学式为 。将0.01mol/L的甲溶液与0.03mol/L的Ba(OH)2溶液等体积混合得到沉淀,已知该沉淀的Ksp="x" ,则混合溶液中酸根离子的浓度为 mol / L(用含x的代数式表示,混合后溶液体积变化忽略不计)。
(1)B在周期表中位于第______族,甲的名称是___________。
(2)A、C两元素按原子数目比3:1和2:1构成分子M和N,N的电子式为___________。在微电子工业中,M的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(3)由C、E组成的化合物乙是汽车安全气囊中的一种成分。现取13.0 g乙,加热使其完全分解,生成一种气体单质(标准状况下的体积为6. 72L)和一种同体单质,则乙的化学式是___________。
(4)近年来太原市汽车拥有量呈较快增长趋势,汽车尾气已成为重要的空气污染物。汽车内燃机工作时引起反应:C2(g)+D2(g)
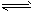 2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=
2CD(g),是导致 汽车尾气中含有CD的原因之一。T℃时,向容积为2L的密闭容器中充入10 mol C2与5 mol D2,达到平衡后CD的物质的量为2 mol,则T℃时该反应的平衡常数K=____________(计算结果保留两位有效数字)。在其他条件不变的情况下,再通入10mol C2与5 mol D2,达到新平衡时C2的转化率将____(填“增大”“减小”或“不变”,下同),CD的平衡浓度将____。
(5)当发动机采用稀薄燃烧时,尾气中的主要污染物为NOx,可用CxHy(烃)催化还原NOx消除氮氧化物的污染。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
CH4(g)+4NO(g)=CO2(g)+2H2O(g)+2N2O(g) △H2
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ/mol
△H2=___________。