摘要:6.元素形成氢化物.特别是lA.11A族活泼金属更是如此.例如钙和氢气在一定温度下发生反应.可生成氢化钙.活泼金属氢化物在熔融态时能导电.金属氢化物与水剧烈反应生成氢气.是优良的氢气发生剂.例如.氢化锂在高温下与二氧化钛反应可得到金属钛TiO2+2LiH高温Ti+2LiOH 由金属元素和氢元素形成的二元化合物叫做金属氢化物.几乎所有的金属元素都能和氢化合.根据以上事实.回答下列问题: (1)常温常压下.金属氢化物呈 态,理由是 , (2)写出钙与氢气反应的化学方程式.并写出电子转移的数目和方向 , (3)写出氢化钙与水反应的化学方程式 , (4)金属氢化物在化学反应中常用作 剂.
网址:http://m.1010jiajiao.com/timu3_id_57554[举报]
下列说法错误的是( )
| A、H2O2和Na2O2都属于氧化物,两种物质中所含的化学键类型完全相同 | B、原子核外在离核较远区域的电子易失去,其原因是这些电子能量较高 | C、第三周期非金属元素形成氢化物的稳定性从左到右逐渐增强 | D、在周期表的金属元素和非金属元素的交界处寻找半导体,在过渡元素区中寻找催化剂 |
W、X、Y、Z是原子序数依次增大的同一短同期的四种元素.W、X是金属元素,Y、Z是非金属元素.Y的氧化物是现代光学及光纤制品的基本原料.请回答:
(1)WZ是生活中常见的盐,实验室检验该盐中阴离子的操作方法和现象为:取少量WZ固体溶于水,
(2)Y在元素周期表中的位置是
(3)Z元素形成氢化物的电子式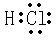
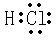 .
.
(4)将W、X的氢氧化物混合,其反应的离子方程式为
(5)0.5mol X单质与足量W的最高价氧化物对应水化物的溶液发生反应,生成气体的体积为
查看习题详情和答案>>
(1)WZ是生活中常见的盐,实验室检验该盐中阴离子的操作方法和现象为:取少量WZ固体溶于水,
滴加硝酸酸化的硝酸银,观察到白色沉淀
滴加硝酸酸化的硝酸银,观察到白色沉淀
,则证明WZ中有该阴离子.(2)Y在元素周期表中的位置是
第三周期第ⅣA族
第三周期第ⅣA族
.(3)Z元素形成氢化物的电子式
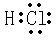
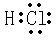
(4)将W、X的氢氧化物混合,其反应的离子方程式为
OH-+Al(OH)3═AlO2-+2H2O
OH-+Al(OH)3═AlO2-+2H2O
.(5)0.5mol X单质与足量W的最高价氧化物对应水化物的溶液发生反应,生成气体的体积为
16.8L
16.8L
(标准状况).元素X、Y、Z原子序数之和为33,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。
下列推测不正确的是
| A.在短周期元素中X的金属性最强 |
| B.Y的最高价含氧酸属于弱酸 |
| C.原子半径Z>Y,离子半径Z2-> X+ |
| D.Y、Z都可与氢元素形成氢化物,Z的氢化物比Y的氢化物稳定 |