摘要:1.(1)3H2S+2Fe(OH)3=Fe2S3+6H2O b (4)生产纯碱 (5)
网址:http://m.1010jiajiao.com/timu3_id_57330[举报]
已知:甲、乙、丙为常见单质,甲常温下为固体,乙为一黄绿色气体,丙为无色气体.A、B、C、D均为化合物,D为一红褐色沉淀,它们之间有下图转化关系.请回答以下问题.
(1)气体乙是
(2)沉淀D是
(3)写出②反应的离子方程式:
(4)气体丙是
查看习题详情和答案>>

(1)气体乙是
Cl2
Cl2
(化学式),在其实验室制法中常用NaOH
NaOH
溶液进行尾气的处理,原理用化学方程式表示为Cl2+2NaOH═NaCl+NaClO+H2O
Cl2+2NaOH═NaCl+NaClO+H2O
.(2)沉淀D是
Fe(OH)3
Fe(OH)3
(化学式),A→D发生的化学反应是FeCl3+3NaOH═Fe(OH)3+3NaCl
FeCl3+3NaOH═Fe(OH)3+3NaCl
.(3)写出②反应的离子方程式:
2Fe3++Fe═3Fe2+
2Fe3++Fe═3Fe2+
.(4)气体丙是
O2
O2
(化学式),在操作③中观察到的实验现象是白色沉淀变成灰绿色沉淀最终变成红褐色沉淀
白色沉淀变成灰绿色沉淀最终变成红褐色沉淀
.(2008?宁夏)某厂的酸性工业废水中含有一定量的Fe3+、Cu2+、Au3+等离子.有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜.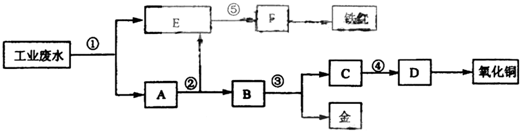
填写下面空白.
(1)图中标号处需加入的相应物质分别是①
(2)写出①处发生反应的离子方程式
(3)铁红的化学式为
查看习题详情和答案>>

填写下面空白.
(1)图中标号处需加入的相应物质分别是①
铁屑
铁屑
、②稀硫酸
稀硫酸
、③稀硝酸
稀硝酸
、④氢氧化钠
氢氧化钠
、⑤氢氧化钠
氢氧化钠
.(2)写出①处发生反应的离子方程式
Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;Cu2++Fe=Cu+Fe2+;2Au3++3Fe=2Au+3Fe2+
Fe+2H+=Fe2++H2↑;2Fe3++Fe=3Fe2+;Cu2++Fe=Cu+Fe2+;2Au3++3Fe=2Au+3Fe2+
.写出③处发生反应的化学方程式3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
.(3)铁红的化学式为
Fe2O3
Fe2O3
;分别写出铁红和氧化铜在工业上的一种主要用途:铁红用作红色涂料
用作红色涂料
;氧化铜用作制造铜盐的原料
用作制造铜盐的原料
.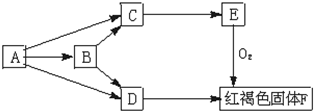 中学化学常见物质A、B、C、D、E有如下转化(已知A、B、C、D、E均含有同一元素):
中学化学常见物质A、B、C、D、E有如下转化(已知A、B、C、D、E均含有同一元素):请写出:
(1)B→C+D的离子方程式
Fe3O4+8H+=Fe2++2Fe3++4H2O
Fe3O4+8H+=Fe2++2Fe3++4H2O
;(2)E→F化学方程式
4Fe(OH)2+O2+2H2O=4Fe(OH)3
4Fe(OH)2+O2+2H2O=4Fe(OH)3
.(3)若A→B过程的反应不是化合反应,试写出该反应可能的化学方程式
3Fe+4H2O
Fe3O4+H2↑
| ||
3Fe+4H2O
Fe3O4+H2↑
.
| ||
(4)D通过化合反应转化为C的离子方程式为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
.(2011?门头沟区模拟)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:A
B
C
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体.则A转化为B反应的化学方程式为
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的电子式为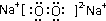
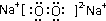 .
.
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子.则B转化为C的离子方程式为
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为
(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成.则A生成B的化学方程式为
查看习题详情和答案>>
| +D |
| 一定条件 |
| +D |
| 一定条件 |
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体.则A转化为B反应的化学方程式为
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
.
| ||
| △ |
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C的电子式为
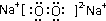
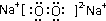
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明)
加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe═3Fe2+
加入少量铁,防止Fe2+被氧化为Fe3+,2Fe3++Fe═3Fe2+
.(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子.则B转化为C的离子方程式为
CO2+CO32-+H2O=2HCO3-
CO2+CO32-+H2O=2HCO3-
.(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为
AlO2-
AlO2-
.(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为
O=C=O
O=C=O
.(7)若A的体积分数为75%的溶液可用作医疗消毒剂;B与新制氢氧化铜共热,有砖红色沉淀生成.则A生成B的化学方程式为
2CH3CH2OH+O2
2CH3CHO+2H2O
| 催化剂 |
| 加热 |
2CH3CH2OH+O2
2CH3CHO+2H2O
.| 催化剂 |
| 加热 |
甲、乙、丙、丁为四种常见单质,常温下,乙、丙、丁为气体.丙常用于自来水消毒,甲是生活中常见金属,A在通常情况下为无色液体,B、C在溶液中反应.
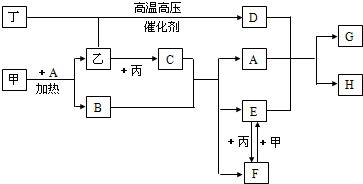
(1)D的化学式为
(2)甲+A反应的化学方程式为
(3)F+甲反应的离子方程式为
(4)A+D+E反应的离子方程式为
查看习题详情和答案>>

(1)D的化学式为
NH3
NH3
;闻气体丙的正确方法是扇闻
扇闻
;取少量长期放置的丙的水溶液,滴入几滴石蕊试液,可观察到的现象是溶液变红
溶液变红
.(2)甲+A反应的化学方程式为
3Fe+4H2O
Fe3O4+4H2
| ||
3Fe+4H2O
Fe3O4+4H2
.
| ||
(3)F+甲反应的离子方程式为
2Fe3++Fe=3Fe2+
2Fe3++Fe=3Fe2+
;该反应中,证明甲适量或过量的方法是取少量反应后的溶液于试管中,滴入几滴KSCN溶液,若溶液不变色,说明甲过量或适量
取少量反应后的溶液于试管中,滴入几滴KSCN溶液,若溶液不变色,说明甲过量或适量
.(4)A+D+E反应的离子方程式为
Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+
Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+
;该反应能顺利进行,是利用了D的极易溶于水且溶于水后显碱性
极易溶于水且溶于水后显碱性
的性质;若反应在试管中进行一,则其现象为先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色
先生成白色絮状沉淀,迅速变成灰绿色,最后变成红褐色
.