摘要:12.不能比较出金属M比金属N的还原性强的是 ( ) A.M+与N2+离子的电子层结构均与氩原子相同k+s-5#u B.M原子的最外层电子数比N原子少 C.M能从N的可溶性的盐溶液中置换出N D.M.N在电解质溶液中构原电池.M做负极
网址:http://m.1010jiajiao.com/timu3_id_56692[举报]
(2008?深圳二模)下表是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.
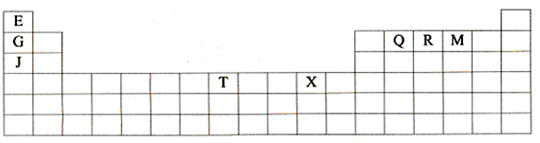
(1)T3+的核外电子排布式是:
(2)Q、R、M的第一电离能由大到小的顺序是
(3)下列有关上述元素的说法中,正确的是:
①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键.写出其结构式:
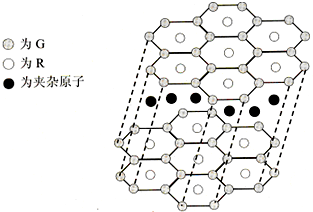
(5)G与R单质直接化合生成一种离子化合物G3R.该晶体具有类似石墨的层状结构.每层中,G原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是
查看习题详情和答案>>


(1)T3+的核外电子排布式是:
[Ar]3d5或1s22s22p63s23p63d5
[Ar]3d5或1s22s22p63s23p63d5
(2)Q、R、M的第一电离能由大到小的顺序是
N>O>C
N>O>C
(用元素符号表示)(3)下列有关上述元素的说法中,正确的是:
①③⑤
①③⑤
(填序号)①G单质的熔点高于J单质,是因为G单质的金属键较强
②J比X活泼,所以J可以在溶液中置换出X
③将J2M2溶于水,要破坏离子键和共价键
④RE3沸点高于QE4,主要是因为前者相对分子质量较大
⑤一个Q2E4分子中含有五个σ键和一个π键
(4)加拿大天文台在太空发现了EQ9R,已知分子中所有原子均形成8电子或2电子稳定结构,是直线型分子,不存在配位键.写出其结构式:
H-C≡C-C≡C-C≡C-C≡C-C≡N
H-C≡C-C≡C-C≡C-C≡C-C≡N
(5)G与R单质直接化合生成一种离子化合物G3R.该晶体具有类似石墨的层状结构.每层中,G原子构成平面六边形,每个六边形的中心有一个R原子.层与层之间还夹杂一定数量的原子.请问这些夹杂的原子应该是
Li
Li
(填G或R的元素符号)