摘要:3.一部分.表中所列的字母分别代表某一元素. (1)1molA与D的氢化物完全反应产生的气体在标准状况下的体积为 . (2)写出B的最高价氧化物的电子式 . (3)表中的另一种金属元素的单质G.可以发生如下图所示转化 其中化合物M是一种白色胶状沉淀.则M的化学式为 , K的溶液与B的某种氧化物反应的化学方程式为 ,L与氨水反应的离子方程式为 , 一种新型无机非金属材料由G元素和C元素组成.其化学式为 .
网址:http://m.1010jiajiao.com/timu3_id_56635[举报]
下表是元素周期表的一部分.表中所列的字母分别代表某一化学元素.
(1)下列
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)原子半径最小的元素
(3)最高价氧化物对应水化物酸性最强的是
(4)j、i对应的离子还原性由强到弱顺序为
(5)设计实验比较a、c的金属性强弱
查看习题详情和答案>>
| b | |||||||||||||||||
| h | j | ||||||||||||||||
| a | c | f | i | l | m | ||||||||||||
| e | g | ||||||||||||||||
| d | k | ||||||||||||||||
①④
①④
(填写编号)组元素的单质可能都是电的良导体.①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)原子半径最小的元素
H
H
单质化学性质最稳定的元素是Ar
Ar
(均填元素符号).(3)最高价氧化物对应水化物酸性最强的是
HClO4
HClO4
(填化学式)(4)j、i对应的离子还原性由强到弱顺序为
S2->O2-
S2->O2-
(填离子符号)(5)设计实验比较a、c的金属性强弱
将一定量的金属钠和金属镁放入冷水中,反应剧烈的是金属钠,反应不剧烈的是金属镁
将一定量的金属钠和金属镁放入冷水中,反应剧烈的是金属钠,反应不剧烈的是金属镁
.下表是元素周期表的一部分.表中所列的字母分别代表某一种化学元素.

(1)X原子的价电子排布式是:
(2)M元素在周期表中的位置是第
(3)Q、R、M的第一电离能由大到小的顺序是
(4)E与Q所形成的化合物含
(5)Fe2+与Mn2+两种离子,
(6)用氢键表示式写出W的氢化物溶液中存在的所有氢键
查看习题详情和答案>>

(1)X原子的价电子排布式是:
3d104s1
3d104s1
;(2)M元素在周期表中的位置是第
二
二
周期第ⅥA
ⅥA
族;(3)Q、R、M的第一电离能由大到小的顺序是
N>O>C
N>O>C
(用元素符号表示);(4)E与Q所形成的化合物含
极性
极性
键,属非极性
非极性
分子.(填“极性”或“非极性”)(5)Fe2+与Mn2+两种离子,
Fe2+
Fe2+
更容易再失去1个电子,原因是亚铁离子的价电子式为3d6,锰离子的价电子式为3d5,d轨道处于半充满状态更稳定,而亚铁离子需要失去一个电子才达到半充满稳定状态,所以亚铁离子更容易再失去1个电子
亚铁离子的价电子式为3d6,锰离子的价电子式为3d5,d轨道处于半充满状态更稳定,而亚铁离子需要失去一个电子才达到半充满稳定状态,所以亚铁离子更容易再失去1个电子
.(6)用氢键表示式写出W的氢化物溶液中存在的所有氢键
F-H…F、F-H…O、O-F…F、O-H…O
F-H…F、F-H…O、O-F…F、O-H…O
. 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | ||||||||||||||||
(1)a的氢化物的分子构型为
三角锥形
三角锥形
,中心原子的杂化形式为sp3
sp3
;d在空气中燃烧产物的分子构型为V形
V形
,中心原子的杂化形式为sp2
sp2
,该分子是极性
极性
(填“极性”或“非极性”)分子.(2)b、d、e三种元素的氢化物中的沸点最高的是
HF
HF
,原因是:HF分子间形成氢键,HCl、H2S分子间没有氢键
HF分子间形成氢键,HCl、H2S分子间没有氢键
.(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子.此配合离子空间构型为
平面正方形
平面正方形
,请写出生成此配合离子的离子方程式:Cu2++4H2O=[Cu(H2O)4]2+
Cu2++4H2O=[Cu(H2O)4]2+
.(4)f(NH3)5BrSO4可形成两种配合物,已知f3+的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2 溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为
[Co(NH3)5SO4]Br
[Co(NH3)5SO4]Br
,该配合物的配体是NH3
NH3
、SO42-
SO42-
;(5)c单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示.
c单质晶体中原子的配位数为
12
12
.若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M.该晶体的密度为| M | ||
4
|
| M | ||
4
|
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
试回答下列问题:
(1)请写出元素m的基态原子电子排布式
(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表
(3)由a原子跟f原子以1:1相互交替结合而形成的晶体,晶型与晶体f相同.两者相比熔点更高的是
(4)b、n、m元素化合物的晶体中的晶胞堆积方式如图2所示:
请回答:该化合物的化学式是:
查看习题详情和答案>>
| a | b | ||||||||||||||||
| c | d | e | f | i | j | k | l | ||||||||||
| n | m | ||||||||||||||||
(1)请写出元素m的基态原子电子排布式
1s22s22p63s23p63d24s2
1s22s22p63s23p63d24s2
.(2)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表
Si
Si
(填元素符号);其中电负性最大的是2
2
(填图1中的序号).(3)由a原子跟f原子以1:1相互交替结合而形成的晶体,晶型与晶体f相同.两者相比熔点更高的是
SiC
SiC
(填化学式).(4)b、n、m元素化合物的晶体中的晶胞堆积方式如图2所示:

请回答:该化合物的化学式是:
CaTiO3
CaTiO3
(用元素符号表示),与m原子距离相等且最接近的m原子数为6
6
.如表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
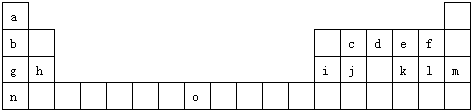
试回答下列问题:
(1)请写出元素O的基态原子电子排布式 .
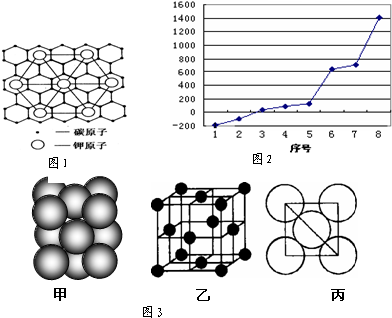
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图1,则x值为 .
(3)第三周期8种元素按单质熔点高低的顺序如图2,其中序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号).
(4)由i原子跟d原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为 ,d原子的杂化类型为 .
(5)i单质晶体中原子的堆积方式如图3甲所示,其晶胞特征如图3乙所示,原子之间相互位置关系的平面图如图3丙所示.若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,则该晶体的密度为 _g/cm3 (用字母表示).
查看习题详情和答案>>

试回答下列问题:

(1)请写出元素O的基态原子电子排布式
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图1,则x值为
(3)第三周期8种元素按单质熔点高低的顺序如图2,其中序号“8”代表
(4)由i原子跟d原子以1:1相互交替结合而形成的晶体,晶型与晶体j相同.则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为
(5)i单质晶体中原子的堆积方式如图3甲所示,其晶胞特征如图3乙所示,原子之间相互位置关系的平面图如图3丙所示.若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,则该晶体的密度为