摘要:1.合理答案均可酌情给分.但不得超过原题分数.
网址:http://m.1010jiajiao.com/timu3_id_56448[举报]
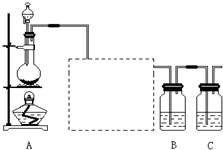 已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
已知非金属单质硫(S)是淡黄色固体粉末,难溶于水.为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:(1)装置A的分液漏斗中盛装的试剂是
浓盐酸
浓盐酸
,烧瓶中加入的试剂是MnO2
MnO2
.(2)画出虚线框内的实验装置图,并注明所加试剂,


除去Cl2中的HCl气体
除去Cl2中的HCl气体
.(3)装置B中盛放的试剂是
A
A
(选填下列所给试剂的代码),实验现象为有淡黄色沉淀生成
有淡黄色沉淀生成
,化学反应方程式是Na2S+Cl2=2NaCl+S↓
Na2S+Cl2=2NaCl+S↓
,该反应属于四种基本反应类型中的置换
置换
反应.A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)从原子结构的角度简要分析氯元素的非金属性比硫元素的非金属性强的原因.
Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
Cl原子、S原子的电子层数相同,但最外层电子数Cl原子是7,S原子是6,且原子半径Cl<S,因此,在反应中Cl原子比S原子更容易获得电子达稳定结构,故氯元素的非金属性比硫元素的非金属性强.
(5)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例).
HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强.(其他合理答案均可)
HCl的稳定性比H2S的稳定性强或者HClO4的酸性比H2SO4的酸性强.(其他合理答案均可)
(6)装置C中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气.在该反应中,Cl元素的化合价既有升高又有降低,即在反应中Cl元素的原子既能获得电子也能失去电子,能否说氯元素既具有金属性又具有非金属性?简述你的理由.
不能
不能
金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)
金属性强弱的判断以元素的单质与水(或酸)反应置换氢的难易程度,以及它的最高价氧化物的水化物的碱性强弱为依据.非金属性的强弱以它与氢气生成氢化物的稳定性或它的最高价氧化物的水化物的酸性强弱来判断.(其他合理答案均可)
.(6分)现有下列四种物质:Na2SO4、BaSO4、蔗糖(C12H22O11)、H2SO4,按照一定的依据,能找出一种物质与其它三种物质不同,从而分成两类.请你试试看,一共能找出多少种分法,把分类的依据和结果写在下面的表格中.(填三种即可)
查看习题详情和答案>>
| 与其它三种不同的物质 | 分类依据 |
| 蔗糖 | 蔗糖为有机物,另外三种为无机物 |
| 其他合理答案均可,每空1分,共6分 | |
 如图是实验室制氨气的装置图,请回答:
如图是实验室制氨气的装置图,请回答:①写出实验室制取氨气的化学反应方程式:
2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
 CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O②收集氨气用
向下排空气法
向下排空气法
法,③干燥氨气可选用
碱石灰
碱石灰
④如何检验氨气是否收集满:
使湿润的红色石蕊试纸变蓝(合理答案均可)
使湿润的红色石蕊试纸变蓝(合理答案均可)
⑤实验装置中棉花的作用是:
氨气逸出,污染环境
氨气逸出,污染环境
.硫酸锌是制备荧光粉的原料之一.工业上用锌白矿(主要成分是ZnO,还含有Fe2O3、CuO、SiO2等杂质)制备ZnSO4?7H2O的流程如下:

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7、6.5、9.6.
(1)浸取过程中,为提高浸出效率可采用的措施有
(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;②
(3)氧化过程中,H2O2发生反应的离子方程式为
(4)加入适量Ca(OH)2调节溶液pH、促进Fe3+水解,则Fe3+水解反应的平衡常数表达式K=
;Ca(OH)2不能过量的原因是
查看习题详情和答案>>

已知:常温下,溶液中的Fe3+、Zn2+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7、6.5、9.6.
(1)浸取过程中,为提高浸出效率可采用的措施有
将矿石粉碎(或提高浸取时的温度,或适当增大酸的浓度等合理答案均可)
将矿石粉碎(或提高浸取时的温度,或适当增大酸的浓度等合理答案均可)
.(任答一条)ZnO与稀硫酸反应的化学方程式为ZnO+H2SO4(稀)═ZnSO4+H2O
ZnO+H2SO4(稀)═ZnSO4+H2O
.(2)加入适量锌粉的作用为:①使溶液中的Fe3+转化为Fe2+;②
除去Cu2+
除去Cu2+
.(3)氧化过程中,H2O2发生反应的离子方程式为
H2O2+2Fe2++2H+═2Fe3++2H2O
H2O2+2Fe2++2H+═2Fe3++2H2O
.(4)加入适量Ca(OH)2调节溶液pH、促进Fe3+水解,则Fe3+水解反应的平衡常数表达式K=
| c3(H+) |
| c(Fe3+) |
| c3(H+) |
| c(Fe3+) |
防止生成Zn(OH)2
防止生成Zn(OH)2
.(2011?南京一模)富马酸亚铁(分子式C4H2O4Fe,结构简式  是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂
(1)如图为实验室模拟工业制取富马酸亚铁的流程图:

①绿矾(FeSO4?7H20)在保存过程中形成的杂质主要有
②操作Y包括
⑧判断操作Y中“洗涤”富马酸亚铁产品已洗净的实验方法是
(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有:KSCN溶液、KMn04溶液、稀硫酸.已知SCN一能被MnO4-氧化).填写下表相应空格:
查看习题详情和答案>>
 是一种可限量使用的铁强化剂
是一种可限量使用的铁强化剂(1)如图为实验室模拟工业制取富马酸亚铁的流程图:

①绿矾(FeSO4?7H20)在保存过程中形成的杂质主要有
Fe2(SO4)3、Fe(OH)3等(其他合理答案均可)
Fe2(SO4)3、Fe(OH)3等(其他合理答案均可)
(填写化学式).②操作Y包括
蒸发浓缩
蒸发浓缩
冷却结晶、过滤、洗涤、干燥等.⑧判断操作Y中“洗涤”富马酸亚铁产品已洗净的实验方法是
取最后洗涤液,向其中加入少量盐酸酸化的氯化钡溶液,无白色沉淀(其他合理答案均可)
取最后洗涤液,向其中加入少量盐酸酸化的氯化钡溶液,无白色沉淀(其他合理答案均可)
.(2)设计一个实验方案,证明所得富马酸亚铁产品属于亚铁盐(可供选用的试剂有:KSCN溶液、KMn04溶液、稀硫酸.已知SCN一能被MnO4-氧化).填写下表相应空格:
| 步骤 | 实验操作与现象 |
| ① | 取富马酸亚铁产品l.5g,加入稀硫酸25mL,用水稀释至50ml,加热使其完全溶解并反应,冷却后过滤(除去生成的富马酸及可能过量的反应物),保存滤液. |
| ② | 取少量滤液,滴加KSCN溶液,不显红色 取少量滤液,滴加KSCN溶液,不显红色 |
| ③ | 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 取酸性高锰酸钾溶液适量,向其中滴加滤液至溶液褪色 |
| ④ | 取上述褪色后的溶液,滴加KSCN溶液显红色 取上述褪色后的溶液,滴加KSCN溶液显红色 |