题目内容
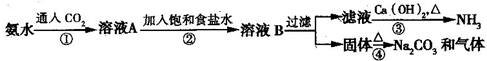
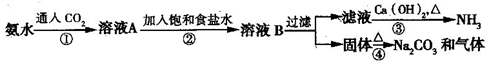
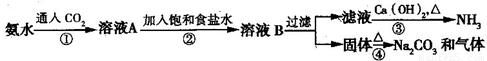
索尔维制碱法距今已有140多年的历史,为当时世界各国所采用,后被中国的侯氏制碱法取代.索尔维法的生产流程如下所示:
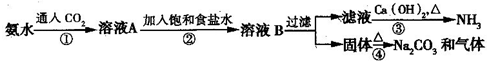
索尔维法能实现连续生产,但食盐的利用率只有70%,且副产品CaCl2没有合适的用途,会污染环境.
1940年我国化学家侯德榜先生经过多次试验,弥补了索尔维法的技术缺陷,加以改进,食盐利用率高达96%,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”.此方法的基本原理如下:
①向30~50℃的饱和食盐水中,先通入氨气至饱和,再通入CO2,从而得到碳酸氢钠沉淀.
②过滤,将滤渣加热而得产品.
③向滤液中加入细食盐末,调节温度为10~15℃,使NH4Cl沉淀,过滤,滤渣为NH4Cl产品,滤液为饱和食盐水.
请回答下列问题:
(1)写出向含氨气的饱和NaCl溶液中通入CO2 时发生反应的两个化学方程式:
(2)不能向饱和NaCl溶液中通入CO2 制NaHCO3的原因是
(3)写出在索尔维法生产过程中,生成CaCl2 的化学反应方程式为
(4)在侯氏制碱法中,
(5)侯氏制碱法与索尔维法相比,其优点是

索尔维法能实现连续生产,但食盐的利用率只有70%,且副产品CaCl2没有合适的用途,会污染环境.
1940年我国化学家侯德榜先生经过多次试验,弥补了索尔维法的技术缺陷,加以改进,食盐利用率高达96%,得到了纯碱和氯化铵两种产品,被称为“侯氏制碱法”.此方法的基本原理如下:
①向30~50℃的饱和食盐水中,先通入氨气至饱和,再通入CO2,从而得到碳酸氢钠沉淀.
②过滤,将滤渣加热而得产品.
③向滤液中加入细食盐末,调节温度为10~15℃,使NH4Cl沉淀,过滤,滤渣为NH4Cl产品,滤液为饱和食盐水.
请回答下列问题:
(1)写出向含氨气的饱和NaCl溶液中通入CO2 时发生反应的两个化学方程式:
CO2+NH3+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl
CO2+NH3+H2O=NH4HCO3、NH4HCO3+NaCl=NaHCO3↓+NH4Cl
.(2)不能向饱和NaCl溶液中通入CO2 制NaHCO3的原因是
H2CO3酸性比盐酸弱,CO2与NaCl不反应
H2CO3酸性比盐酸弱,CO2与NaCl不反应
;也不能采用先向饱和NaCl溶液中通入CO2,再通入NH3的方法制NaHC03 的原因是CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶析出
CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶析出
.(3)写出在索尔维法生产过程中,生成CaCl2 的化学反应方程式为
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O
.(4)在侯氏制碱法中,
二氧化碳和饱和食盐水
二氧化碳和饱和食盐水
(填物质名称)可以循环利用.(5)侯氏制碱法与索尔维法相比,其优点是
使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用
使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用
(任写一条即可).分析:(1)在饱和NaCl溶液中通入足量氨气以后再通入CO2时,先生成NH4HCO3,进而生成NaHCO3;
(2)H2CO3酸性比盐酸弱,CO2与NaCl不反应且CO2在NaCl溶液中溶解度较小;
(3)在索尔维法生产过程中,氢氧化钙和铵盐反应生成氨气,同时生成氯化钙;
(4)将滤渣加热可生成二氧化碳,过滤后得到滤液为饱和食盐水,都可循环利用;
(5)分析比较两种制备流程,结合反应生成产物比较异同,从副产物的主要作用和原料利用等分析比较.
(2)H2CO3酸性比盐酸弱,CO2与NaCl不反应且CO2在NaCl溶液中溶解度较小;
(3)在索尔维法生产过程中,氢氧化钙和铵盐反应生成氨气,同时生成氯化钙;
(4)将滤渣加热可生成二氧化碳,过滤后得到滤液为饱和食盐水,都可循环利用;
(5)分析比较两种制备流程,结合反应生成产物比较异同,从副产物的主要作用和原料利用等分析比较.
解答:解:(1)在饱和NaCl溶液中通入足量氨气以后再通入CO2时,则发生以下反应:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NH4Cl+NaHCO3↓,其中NaHCO3溶解度最小,故有NaHCO3的晶体析出,
故答案为:NH3+CO2+H2O=NH4HCO3、NH4HCO3+NaCl=NH4Cl+NaHCO3↓;
(2)H2CO3酸性比盐酸弱,CO2与NaCl不反应,则不能向饱和NaCl溶液中通入CO2 制NaHCO3;
另CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶析出,所以也不能采用先向饱和NaCl溶液中通入CO2,再通入NH3的方法制NaHC03 ,
故答案为:H2CO3酸性比盐酸弱,CO2与NaCl不反应;CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶析出;
(3)在索尔维法生产过程中,氢氧化钙和铵盐反应生成氨气,同时生成氯化钙,反应的方程式为2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
(4)将滤渣加热可生成二氧化碳,过滤后得到滤液为饱和食盐水,都可循环利用,
故答案为:二氧化碳和饱和食盐水;
(5)索尔维法缺点:大量CaCl2用途不大,NaCl利用率只有70%,约有30%的NaCl留在母液中.
侯氏制碱法的优点:把合成氨和纯碱两种产品联合生产,提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本.保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%;NH4Cl可做氮肥;可与合成氨厂联合,使合成氨的原料气CO转化成CO2,减少无用的氯化钙生成,
故答案为:使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用.
故答案为:NH3+CO2+H2O=NH4HCO3、NH4HCO3+NaCl=NH4Cl+NaHCO3↓;
(2)H2CO3酸性比盐酸弱,CO2与NaCl不反应,则不能向饱和NaCl溶液中通入CO2 制NaHCO3;
另CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶析出,所以也不能采用先向饱和NaCl溶液中通入CO2,再通入NH3的方法制NaHC03 ,
故答案为:H2CO3酸性比盐酸弱,CO2与NaCl不反应;CO2在NaCl溶液中溶解度较小,生成NaHCO3太少不会结晶析出;
(3)在索尔维法生产过程中,氢氧化钙和铵盐反应生成氨气,同时生成氯化钙,反应的方程式为2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2=CaCl2+2NH3↑+2H2O;
(4)将滤渣加热可生成二氧化碳,过滤后得到滤液为饱和食盐水,都可循环利用,
故答案为:二氧化碳和饱和食盐水;
(5)索尔维法缺点:大量CaCl2用途不大,NaCl利用率只有70%,约有30%的NaCl留在母液中.
侯氏制碱法的优点:把合成氨和纯碱两种产品联合生产,提高了食盐利用率,缩短了生产流程,减少了对环境的污染,降低了纯碱的成本.保留了氨碱法的优点,消除了它的缺点,使食盐的利用率提高到96%;NH4Cl可做氮肥;可与合成氨厂联合,使合成氨的原料气CO转化成CO2,减少无用的氯化钙生成,
故答案为:使NH4Cl析出,可做氮肥;减少无用的CaCl2生成,原料NaCl充分利用.
点评:本题考查了纯碱工业制备原理分析比较,反应实质的应用,试剂的作用,理解生产原理和过程的实质是解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目