摘要: Y是短周期元素组成的单质.为淡黄色固体.Z是一种化合物.焰色反应呈黄色.0.1mol·L-1 Z的水溶液pH=13,C.Y.D都含同一种元素.且此元素化合价依次升高.C.D的水溶液均显碱性. I.写出Y与Z反应的离子方程式: II.某同学在精确测试D溶液的pH操作时.遇到了困惑. [实验操作]①准确称取纯净的Na2SO3·7H2O晶体25.20g.配成1L水溶液.测得其pH=7.8. ②再次准确称取25.20g上述晶体.继而隔绝空气600℃以上高温下强热至恒重. ③将②所得12.60g固体进行分析.组成与D无异.将其溶于水测得pH=10.3. [查阅资料]①H2S的电离常数 K1=1.3×10-7 K2=7.1×10-15 ②H2SO3的电离常数 K1=1.3×10-2 K2=6.2×10-8 [分析猜想]D·7H2O在强热下失去结晶水.进而发生了分解反应 [交流讨论] (1)判断实验操作②中隔绝空气强热至“恒重 的依据 . (2) 猜想D在高温强热下发生分解反应的化学方程式是 . (3)实验操作①和③中.两次测得的溶液pH相差明显.其合理的解释是 . (4) 请你设计简单的实验方案.验证猜想的正确性.简单叙述实验步骤.现象和结论.
网址:http://m.1010jiajiao.com/timu3_id_55516[举报]
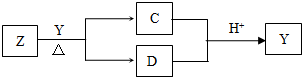 Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.
Y是短周期元素组成的单质,为淡黄色固体.Z是一种化合物,焰色反应呈黄色,0.1mol?L-1 Z的水溶液pH=13;C、Y、D都含同一种元素,且此元素化合价依次升高.C、D的水溶液均显碱性.
I、写出Y与Z反应的离子方程式:______.
II、某同学在精确测试D溶液的pH操作时,遇到了困惑.
[实验操作]
①准确称取纯净的Na2SO3?7H2O晶体25.20g,配成1L水溶液,测得其pH=7.8.
②再次准确称取25.20g上述晶体,继而隔绝空气600℃以上高温下强热至恒重.
③将②所得12.60g固体进行分析,组成与D无异.将其溶于水测得pH=10.3.
[查阅资料]
①H2S的电离常数(25℃) K1=1.3×10-7 K2=7.1×10-15
②H2SO3的电离常数(25℃) K1=1.3×10-2 K2=6.2×10-8
[分析猜想]D?7H2O在强热下失去结晶水,进而发生了分解反应(自身氧化还原反应)
[交流讨论]
(1)判断实验操作②中隔绝空气强热至“恒重”的依据______.
(2)猜想D在高温强热下发生分解反应的化学方程式是______.
(3)实验操作①和③中,两次测得的溶液pH相差明显,其合理的解释是______.
(4)请你设计简单的实验方案,验证猜想的正确性.简单叙述实验步骤、现象和结论.______.
查看习题详情和答案>>
①四种短周期元素中有两种元素在同一主族;
②X的核电荷数比Y少2个;
③五种元素中M的原子序数最小,且核外电子层数和其他元素核外电子层数都不同;
④五种元素中有两种元素可以形成AB型、A2B3型、A3B4型等多种化合物;
⑤X和Y可以形成XY、XY2等化合物;
⑥Z和W可以形成WZ、WZ2等化合物;
请回答:







⑴④中AB型、A2B3型、A3B4型化合物的化学式分别是 、 、 。
⑵甲、乙、丙三种常见的可燃气体是由这五种元素中的一种或多种元素组成的。甲、乙、丙燃烧时都发生蓝色或淡蓝色火焰。甲、乙、丙的化学式是 、 、 。
⑶很多反应都可以生成M单质,请写出两个生成M单质反应的化学方程式(要求:参加反应的物质由五种元素中的一种或多种元素组成,反应条件不同于实验室制取M单质的反应条件): 、 。
⑷已知WZ2可以在高温条件下和空气中的氧气反应,1mol WZ2充分反应,放出853kJ的热量,该反应的热化学方程式为 。
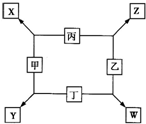 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.请回答下列问题:
(1)X中化学键类型为
离子键、非极性键
离子键、非极性键
.实验室制备W的化学方程式为2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
| ||
2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O
.
| ||
(2)将题小粒甲投入FeCl3溶液中,可观察到的主要现象是
钠融化为小球,在液面上四处游动,发出嘶嘶声,最后消失,有红褐色沉淀产生
钠融化为小球,在液面上四处游动,发出嘶嘶声,最后消失,有红褐色沉淀产生
.(3)写出下列反应的化学方程式:
①工业上用W制取Z:
4NH3+5O2
4NO+6H2O
| ||
| △ |
4NH3+5O2
4NO+6H2O
;
| ||
| △ |
②Y与水反应生成丁:
NaH+H2O=NaOH+H2↑
NaH+H2O=NaOH+H2↑
.在②中,氧化产物和还原产物的质量之比为1:1
1:1
.(4)在绿矾形成的溶液中加入适量的X,二者恰好完全反应,写出此反应的离子方程式:
4Na2O2+4Fe2++2H2O=4Fe(OH)3↓+8Na++O2↑
4Na2O2+4Fe2++2H2O=4Fe(OH)3↓+8Na++O2↑
.(5)工业上制备W的条件为
高温、高压和催化剂
高温、高压和催化剂
,选择该条件的理由是氮气分子中存在三键,很稳定,选择高温是由于催化剂活性需要一定温度,且加快化学反应速率,选择高压是为了加快反应速率和提高原料的转化率
氮气分子中存在三键,很稳定,选择高温是由于催化剂活性需要一定温度,且加快化学反应速率,选择高压是为了加快反应速率和提高原料的转化率
.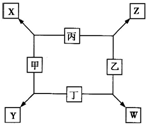 甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
请回答下列问题:
(1)X中化学键类型为______.实验室制备W的化学方程式为______.
(2)将题小粒甲投入FeCl3溶液中,可观察到的主要现象是______.
(3)写出下列反应的化学方程式:
①工业上用W制取Z:______;
②Y与水反应生成丁:______.在②中,氧化产物和还原产物的质量之比为______.
(4)在绿矾形成的溶液中加入适量的X,二者恰好完全反应,写出此反应的离子方程式:______.
(5)工业上制备W的条件为______,选择该条件的理由是______.
查看习题详情和答案>>
甲、乙、丙、丁均是由短周期元素组成的单质,X、Y、Z、W均为化合物,常温下,X为淡黄色固体,Z遇空气变为红棕色,W能使湿润的红色石蕊试纸变蓝色,工业上常用W来制取Z,其转化关系如右图所示.
请回答下列问题:
(1)X中化学键类型为______.实验室制备W的化学方程式为______.
(2)将题小粒甲投入FeCl3溶液中,可观察到的主要现象是______.
(3)写出下列反应的化学方程式:
①工业上用W制取Z:______;
②Y与水反应生成丁:______.在②中,氧化产物和还原产物的质量之比为______.
(4)在绿矾形成的溶液中加入适量的X,二者恰好完全反应,写出此反应的离子方程式:______.
(5)工业上制备W的条件为______,选择该条件的理由是______.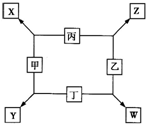
查看习题详情和答案>>
请回答下列问题:
(1)X中化学键类型为______.实验室制备W的化学方程式为______.
(2)将题小粒甲投入FeCl3溶液中,可观察到的主要现象是______.
(3)写出下列反应的化学方程式:
①工业上用W制取Z:______;
②Y与水反应生成丁:______.在②中,氧化产物和还原产物的质量之比为______.
(4)在绿矾形成的溶液中加入适量的X,二者恰好完全反应,写出此反应的离子方程式:______.
(5)工业上制备W的条件为______,选择该条件的理由是______.
