网址:http://m.1010jiajiao.com/timu3_id_55387[举报]
已知C、D、E、H为气体,反应①是工业生产中的重要反应,反应④⑥⑧是实验室重要的物质检验反应,这些物质有如图所示的转化关系(生成物中的水均已略去)。

试回答:
(1)写出化学式:K:__________ H:____________
(2)反应⑦中A溶液显示的性质是:___________
(填序号:A、氧化性;B、还原性;C、酸性;D、碱性)
(3)若X是一种复盐(不考虑结晶水) X的化学式为:____________
(4)写出下列反应的离子方程式:
反应___________________________________;
反应______________________________________;
反应_____________________________________。
查看习题详情和答案>>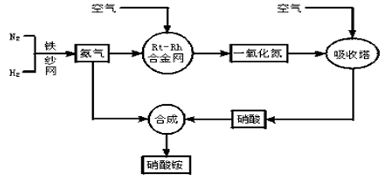
(1)写出硝酸铵在工农业生产中的主要用途____________(任写一条)。
(2)已知N2 (g) +3H2(g)
 2NH3(g) △H = -92kJ . mol-1。请回答:
2NH3(g) △H = -92kJ . mol-1。请回答:①在500℃、200atm和铁催化条件下向一密闭容器中充入 1mol N2和3 mol H2,充分反应后,放出的热量_________(填 “<”“>”或“=”)92.4kJ,理由是_____________。
②为有效提高氢气的转化率,实际生产中宜采取的措施有___________
A.降低温度
B.最适合催化剂活性的适当高温
C.增大压强
D.降低压强
E.循环利用和不断补充氮气
F.及时移出氨
(3)写出氨在铂铑合金网催化氧化下的化学方程式:_________。
(4)在一定温度和压强的密闭容器中,将物质的量之比为 3:2的H2和N2混合,当该反应达到平衡时,测出平衡混合气中氨的体积分数为15%,此时H2的转化率为___________。
(1)A、B、C、D四个容器中的反应,属于氧化还原反应的是
(2)已知:
4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=一1266.8kJ/mol
N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:
氨催化氧化反应的化学平衡常数表达式K=
(3)已知:N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol.为提高氢气的转化率,宜采取的措施有
A.升高温度 B.使用催化剂 C.增大压强 D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为17.6%,此时H2的转化率为
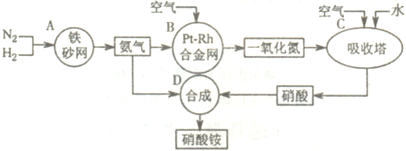
下图是工业生产硝酸铵的流程。

(1)吸收塔C中通入空气的目的是 。
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g) △H= -1266.8kJ/mol
N2(g)+O2(g)=2NO(g) △H=+180.5 kJ/mol
写出氨高温催化氧化的热化学方程式: ,
氨催化氧化反应的化学平衡常数表达式K= 。
(3)已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
2NH3(g) △H=一92 kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为33.33%,此时H2的转化率为 。
查看习题详情和答案>>下图是工业生产硝酸铵的流程。
(1)吸收塔C中通人空气的目的是
A、B、C、D四个容器中的反应,属于氧化还原反应的是 (填字母)。
(2)已知:4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H=-1266.8kJ/mol
N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
写出氨高温催化氧化的热化学方程式:
(3)已知:N2(g)+3H2(g)2NH3(g);△H=-92kJ/mol。为提高氢气的转化率,宜采取的措施有 。(填字母)
A.升高温度 B.使用催化剂 C.增大压强
D.循环利用和不断补充氮气 E.及时移出氨
(4)在一定温度和压强下,将H2和N2按3:1(体积比)在密闭容器中混合,当该反应达到平衡时,测得平衡混合气中NH3的气体体积分数为25%,此时H2的转化率为 。
查看习题详情和答案>>