网址:http://m.1010jiajiao.com/timu3_id_5445[举报]
【实验一】制取氮化铝样品
【查阅资料】在高温下氮气、碳和三氧化二铝反应可以生成氮化铝粉和一氧化碳,用此方法制得的氮化铝中含少量杂质碳和氧化铝.
【实验设计】兴趣小组的同学分成甲、乙两组,分别设计了实验.
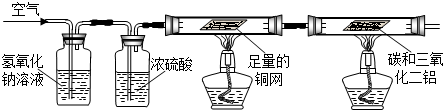
甲组:利用空气为原料,除去其它成分来获得氮气,进而和碳、三氧化二铝反应制取氮化铝.
请回答:
(1)如果洗气瓶A、B中的溶液互换位置,则空气中的
(2)写出D中反应的化学方程式
乙组:利用氨气为原料与氧化铜反应来获得氮气,再和碳、三氧化二铝反应制取氮化铝.
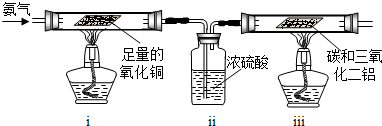
请回答:如果ⅰ中玻璃管内固体变成红色,ⅱ明显增重,请写出ⅰ中发生反应的化学方程式
【实验反思】
(1)请从环保角度指出甲、乙两组实验设计中相同的不足之处:
(2)请比较、评价甲、乙两组实验设计中获得氮气的方法:
【实验二】测定所制氮化铝样品中氮化铝的质量分数
【查阅资料】
(1)Al2O3+2NaOH=2NaAlO2+H2O;
(2)AlN+NaOH+H2O=NaAlO2+NH3↑.
(3)氨气易溶于水且易与酸反应.
【实验设计1】甲组:用图Ⅰ装置使氮化铝样品和NaOH浓溶液反应,根据反应中所生成氨气的体积来测定样品中的氮化铝的质量分数.
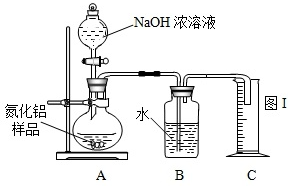
【实验反思】该设计中存在两大问题会引起偏差,请根据偏差结果填写引起相应偏差的原因:
【实验设计2】乙组:实验步骤如下:
①按下图Ⅱ组装仪器,将9.1g氮化铝样品放入锥形瓶中,在分液漏斗中加入一定量的浓NaOH溶液
②称得盛有稀硫酸的烧杯和漏斗的总质量为200g
③打开止水夹C,从分液漏斗向锥形瓶中滴入浓NaOH溶液,直到不再产生气体为止
④打开止水夹B,从导管A处缓缓鼓入一定量的空气
⑤再次称量盛有稀硫酸的烧杯和漏斗的质量和为203.4g
⑥重复实验④⑤步骤后称得盛有稀硫酸的烧杯和漏斗的总质量仍为203.4g稀硫酸
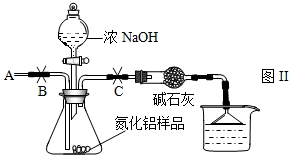
【实验讨论】
(1)步骤①加入样品前还应检查
(2)装有碱石灰的干燥管作用是
(3)如果把烧杯中的稀硫酸换成浓硫酸,测定结果会
(4)步骤④的目的是
【实验结论】计算所制氮化铝样品中氮化铝的质量分数. 查看习题详情和答案>>
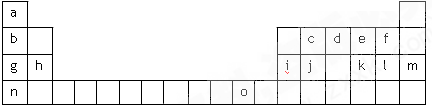

试回答下列问题:
(1
 )
) 按电子排布,可把周期表中的元素划分成5个区,其中j位于 区。
按电子排布,可把周期表中的元素划分成5个区,其中j位于 区。(2)请写出字母o代表的元素的基态原子外围电子排布式 。
(3)第三周期8种元素按单质熔点高低的顺序如图,其中
 序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号)。
序号“8”代表 (填元素符号);其中电负性最大的是 (填右图中的序号),第一电离能最大的是 (填图中的序号)。
(4)由j原子跟c原子以1∶1相互交替结合而形成的晶体,晶体类型与晶体j相同。两者相比熔点更高的是 (填化学式),试从结构角度加以解释:
。
(5)COCl2俗称光气,分子中C原子采取 杂化方式成键;分子中的共价键含有 (填标号)。
a.2个σ键 b.2个π键 c.1个σ键、2个π键 d.3个σ键、1
 个π键
个π键(6)已知[Ni(NH3)2Cl2]可以形成A、B两种固体,则[Ni(NH3)2Cl2] 分子的空间构型
是 。若A在水中溶解度较大,B在CCl4中溶解度较大,试画出A分子的几何构型图 。 查看习题详情和答案>>
 (2013?南通一模)珍珠粉常为消费者喜爱,然而一些不法分子用贝壳粉冒充珍珠粉销售.一研究性学习小组为了鉴定某珍珠粉的真假,进行了以下探究.
(2013?南通一模)珍珠粉常为消费者喜爱,然而一些不法分子用贝壳粉冒充珍珠粉销售.一研究性学习小组为了鉴定某珍珠粉的真假,进行了以下探究.[查阅资料]
①珍珠中含碳酸钙80-93%、蛋白质4-14%、水份2-4%及微量元素等.
②蛋白质与浓硝酸反应变黄色.
③贝壳粉主要成分是碳酸钙(质量分数98%以上).
[实验]
实验一 向盛有少量珍珠粉样品的试管中,滴加少量
实验二 用图所示装置测定珍珠粉样品中碳酸钙的含量.
实验操作:
①按图连接仪器装置.用胶皮管连接B与C时,需要先
②准确称取a g珍珠粉样品装入仪器B中,在A中装入质量分数为b%的盐酸m mL;
③向B内的珍珠粉样品中逐滴加入足量的盐酸;
④完全反应后,A中剩余盐酸n mL,C中的浊液经
⑤计算样品中碳酸钙的含量.
[交流]
装置B中发生反应的化学方程式为
[反思]
若测得样品中碳酸钙的质量分数比实际值小,则可能的原因有
a.原料中可能含有碳酸镁等物质
b.装置B中CO2未完全进入装置C
c.装置B中有部分HCl进入装置C中
d.装置C中玻璃管与空气相通,未密封
[拓展延伸]
有同学提出在实验二中不需要装置C,可用电子天平称量装置A、B反应前后的质量,就可以得到珍珠粉样品中碳酸钙的含量.你认为他的理由是
(1)右图是甲、乙两种同体物质的溶解度曲线,请用“甲”或“乙”填空:
 ①20℃时,__________物质的溶解度为40g;
①20℃时,__________物质的溶解度为40g;
②30℃时,把甲、乙两物质各100g分别配制饱和溶液,需要溶剂质量较多的是______________。
③30℃时,将相同质量的甲和乙的饱和溶液分别冷却到0℃,则析出晶体较多的是______________.
(2)从C、H、O、N、S这5种元素中选择恰当的元素,用离子符号或化学式填空(答案有多种的只需要写出一种即可)。
①空气中含量最多的单质是___________。
②2个硫酸根离子___________。
③相对分子质量为34的化合物是________________ ____。
____。
④由四种元素组成的化肥是_________________。
(3)人体中必需的微量元素有铁、氟、锌、硒、碘等,虽然含量少,但对健康至关重要。下面提供几种微量元素的相关信息,请认真分析并回答下列问题。

①上述微量元素中属于非金属元素的有___________种。
②铁原子核外电子数为_____________。
③硒原子在化学反应中容易得到2个电子,形成___________(填“阴”或“阳”)离子。
查看习题详情和答案>>某同学利用以下药品:长、宽和厚度均相同的锌片、铁片与铜片、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锌溶液、锌粉,进行锌、铁、铜的金属活动性顺序探究等实验。
(1)实验前,用砂纸打磨金属片的目的是 ;
(2)根据实验目的,该同学设计了实验I、Ⅱ两种合理的方案,如图1所示: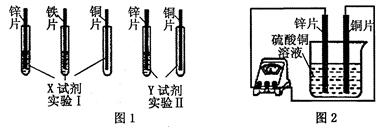
若X、Y是两种不同的试剂,则X、Y中溶质的化学式依次为 、 ;
(3)实验后,该同学将硫酸亚铁溶液和硫酸铜溶液混合在一起,发现溶液呈现青色。他又用混合液分别进行以下实验:
A.向混合液中加入过量锌粉,搅拌,溶液颜色的变化为:青色变浅至 色,最终变为无色;
B.向混合液中插入锌片,待其浸没部分表面完全变色后,溶液仍为青色,取下锌片表面附着的粉末,经检验其组成为铁和铜。和老师一起分析粉末中存在铁的原因:
①反应生成了铁,写出该反应的化学方程式: ;
②铜和锌构成原电池,电子转移过程中亚铁离子得到电子变成铁单质;
(4)如图2所示,该同学用导线将锌片和铜片连接起来,接入电流表,然后把它们一起插入硫酸铜溶液中,该实验的现象为:
①电流表指针是否发生偏转 (选填“是”或“否”);
②铜片表面变粗。