摘要:化学反应N2+3H2=2NH3的能量变化如图所示.该反应的热化学方程式是( ). A.N2(g)+3H2(g)=2NH3(1); △H=2kJ·mol-1 B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a) kJ·mol-1 C.N2(g)+H2(g)=NH3(1); △H= kJ·mol-1 D. N2(g)+H2(g)=NH3(g); △H=(a+b) kJ·mol-1 [解析]理解a.b.c的含义以及符号.a为氮气和氢气分解为氮原子和氢原子吸收的能量.b为氨分子分解为氮原子和氢原子吸收的热量.c为液态氨转化为气态氨吸收的热量.氮气氢气合成氨气的反应热包括氮气氢气分解为氮原子吸收的热量与氮原子氢原子合成氨气放出热量的相对大小.如果生成气态氨.△H=-2kJ/mol.如果生成液态氨△H=-2kJ/mol. [答案]:A. [点评]两种图像.两种视角.形式有别.实质相同.能量变化是化学变化的另一条线索.关注其考查方式.才能更好的理解并灵活运用能量图像解题.突破难点.形成思路方法.
网址:http://m.1010jiajiao.com/timu3_id_54211[举报]
已知化学反应N2+3H2=2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是
(2)
N2(g)+
H2(g)=NH3(g);△H=
(3)N2(g)和H2生成NH3(1)的热化学方程式为

查看习题详情和答案>>
(1)1mol N 和3mol H 生成1mol NH3(g)是
释放
释放
能量的过程(填“吸收”或“释放”).(2)
| 1 |
| 2 |
| 3 |
| 2 |
(a-b)kJ/mol
(a-b)kJ/mol
;(3)N2(g)和H2生成NH3(1)的热化学方程式为
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
.
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2 (g)+3H2 (g)═2NH3 (g);△H<0,反应中NH3的物质的量浓度变化情况如图1:

(1)根据上图,计算从反应开始到平衡时,平均反应速率v (NH3)为
(2)该反应的化学平衡常数表达式K
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(4)在一定条件下,合成氨反应已达化学平衡状态的是
A.3v(H2)(正)=2v(NH3)(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.条件一定,混合气体的平均相对分子质量不再变化
E.单位时间内1mol N≡N键断裂的同时,有3mol H-H键生成
F.单位时间内生成了n mol N2的同时,减少了n mol NH3
(5)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),请在图1中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(7)已知化学反应N2+3H2=2NH3 的能量变化如图2所示,
①1mol N 和3mol H 生成1mol NH3(g)是
②
N2(g)+
H2(g)=NH3(g);△H=
③N2(g)和H2生成NH3(l)的热化学方程式为
查看习题详情和答案>>

(1)根据上图,计算从反应开始到平衡时,平均反应速率v (NH3)为
0.025
0.025
mol/(L?min).(2)该反应的化学平衡常数表达式K
=
| C2(NH3) |
| C (N2)C3(H2) |
=
,随温度升高,K值将| C2(NH3) |
| C (N2)C3(H2) |
减小
减小
(填“增大”、“减小”“不变”).(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
ac
ac
.a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(4)在一定条件下,合成氨反应已达化学平衡状态的是
C、D、E
C、D、E
(填序号).A.3v(H2)(正)=2v(NH3)(逆) B.混合气体的密度保持不变
C.容器内压强保持不变 D.条件一定,混合气体的平均相对分子质量不再变化
E.单位时间内1mol N≡N键断裂的同时,有3mol H-H键生成
F.单位时间内生成了n mol N2的同时,减少了n mol NH3
(5)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
向正反应方向
向正反应方向
移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变
不变
(填“增大”、“减小”或“不变”).(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),请在图1中画出第5分钟末到此平衡时NH3浓度的变化曲线.
(7)已知化学反应N2+3H2=2NH3 的能量变化如图2所示,
①1mol N 和3mol H 生成1mol NH3(g)是
释放
释放
能量的过程(填“吸收”或“释放”).②
| 1 |
| 2 |
| 3 |
| 2 |
(a-b)kJ/mol
(a-b)kJ/mol
;③N2(g)和H2生成NH3(l)的热化学方程式为
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
N2(g)+3H2(g)=2NH3(1)△H=2(a-b-c)kJ?mol-1
.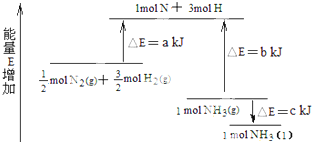
 (2008?重庆)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )
(2008?重庆)化学反应N2+3H2=2NH3的能量变化如图所示,该反应的热化学方程式是( )