摘要:12.[答案]C [分析预测及备考建议]离子浓度的比较是电解质溶液的常考点.一般是以酸.碱.盐为载体.由溶液的酸碱性.根据电荷守恒式.物料守恒式等进行判断和比较. [答题技巧]由题给信息可得BOH是一个弱碱.而HA是一个强酸.因此两者等物质的量混合反应时恰好完全反应生成盐BA.而B+能水解使溶液呈酸性所以A正确.而C不正确,B项是溶液的电荷守恒式,D项是电荷守恒式:c(B+)+c(H+)= c(A-)+c(OH-)与物料守恒式:c(A-)= c(B+)+ c(BOH)两者之和可得:c(H+)=c(BOH)+c(OH-) .因而D也正确.
网址:http://m.1010jiajiao.com/timu3_id_53000[举报]
研究物质性质的基本程序包括:a.观察物质的外观性质,b.实验和观察,c.解释及结论,d.预测物质的性质.下列各项中,排列顺序正确的是( )
| A、abcd | B、bacd | C、adbc | D、dabc |
草酸三氢钾是一种重要的化学试剂,广泛用于分析试剂及缓冲溶液的配制,等级为分析纯(A.R)的产品售价大约每公斤70元.下面是草酸三氢钾的产品标签.
化学名称:草酸三氢钾、四草酸钾、乙二酸三氢钾、四乙二酸钾
英文名:potassium trihydrogen dioxalate dihydrate或potassium tetraoxalate
分子式:KHC2O4…H2C2O4?2H2O或C4H3KO8?2H2O
分子量:254.19
性质:无色晶体或白色粉末.热至100℃失水成无水物,更高温度时分解为碳酸钾和一氧化碳等,溶于水,微溶于醇
质量指标:KHC2O4…H2C2O4?2H2O含量,分析纯(A.R)大于99.5%,化学纯(C.P)大于99.0%
对产品的质量鉴定可以采用氧化还原滴定法,操作步骤如下:称取草酸三氢钾样品1.271g,溶解后定容在100mL容量瓶A中,用移液管移取25.00mL到锥形瓶中,加硫酸酸化后,用0.04000mol?L_1KMnO4溶液滴定至终点,消耗24.91mL.
(1)写出发生的滴定的离子反应方程式
(2)该滴定使用什么指示剂,终点的颜色将怎样变化?
(3)通过计算可知该草酸三氢钾样品的质量分数为
(4)该产品属于哪种等级的化学试剂
(5)采用氧化还原滴定法操作时可以观察到这样的现象,刚刚加入第一滴KMnO4到草酸三氢钾溶液中,溶液呈现紫红色,大约3分钟紫红色褪去,随后加入的KMnO4紫红色则立即褪去.请对这一现象给出解释.
查看习题详情和答案>>
化学名称:草酸三氢钾、四草酸钾、乙二酸三氢钾、四乙二酸钾
英文名:potassium trihydrogen dioxalate dihydrate或potassium tetraoxalate
分子式:KHC2O4…H2C2O4?2H2O或C4H3KO8?2H2O
分子量:254.19
性质:无色晶体或白色粉末.热至100℃失水成无水物,更高温度时分解为碳酸钾和一氧化碳等,溶于水,微溶于醇
质量指标:KHC2O4…H2C2O4?2H2O含量,分析纯(A.R)大于99.5%,化学纯(C.P)大于99.0%
对产品的质量鉴定可以采用氧化还原滴定法,操作步骤如下:称取草酸三氢钾样品1.271g,溶解后定容在100mL容量瓶A中,用移液管移取25.00mL到锥形瓶中,加硫酸酸化后,用0.04000mol?L_1KMnO4溶液滴定至终点,消耗24.91mL.
(1)写出发生的滴定的离子反应方程式
6H++5H2C2O4+2MnO4-═10CO2+8H2O+2Mn2+
6H++5H2C2O4+2MnO4-═10CO2+8H2O+2Mn2+
.(提示:滴定反应可视为草酸与高锰酸钾反应)(2)该滴定使用什么指示剂,终点的颜色将怎样变化?
KMnO4; 最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点
KMnO4; 最后一滴滴入溶液,溶液恰好变紫红色,且30s内不退色,此时便是滴定终点
.(3)通过计算可知该草酸三氢钾样品的质量分数为
99.6%
99.6%
.(4)该产品属于哪种等级的化学试剂
分析纯(A.R)
分析纯(A.R)
.(5)采用氧化还原滴定法操作时可以观察到这样的现象,刚刚加入第一滴KMnO4到草酸三氢钾溶液中,溶液呈现紫红色,大约3分钟紫红色褪去,随后加入的KMnO4紫红色则立即褪去.请对这一现象给出解释.
反应生成的Mn2+起催化作用
反应生成的Mn2+起催化作用
.草酸亚铁用作分析试剂及显影剂等,其制备流程如图甲:
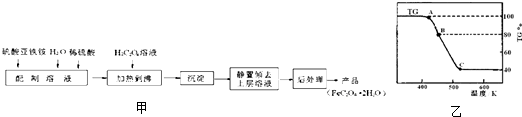
(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
查看习题详情和答案>>

(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
抑制Fe2+水解
抑制Fe2+水解
.(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
| ||
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
.C处时残留物的化学式为
| ||
FeO
FeO
.②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
3FeO+H2O
Fe3O4+H2
| ||
3FeO+H2O
Fe3O4+H2
.
| ||
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
71.4%
71.4%
.【化学—物质结构与性质】(15分)
下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
根据信息回答下列问题:
(1)周期表中比Ga质子数少2的基态原子价电子排布式为 。
(2)Fe元素位于周期表的 分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 ____和 _____(填化学式),CO的结构式为 。
(3)在CH4、CO及CH3OH中,碳原子采取sp3杂化的分子为 。
(4)根据VSEPR理论预测ED4- 离子的空间构型为______________型。B、C、D及E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:__________________________________(写2种) 。
(5)B与D形成的稳定化合物为___________分子(填“极性”“非极性”),其固态为 ________晶体。
查看习题详情和答案>>