网址:http://m.1010jiajiao.com/timu3_id_52997[举报]
I. 现有下列8种物质
① ;②
;② ;③
;③ ;④HF;⑤
;④HF;⑤ ;⑥
;⑥ ;⑦食盐水;⑧
;⑦食盐水;⑧
其中属于强电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟 溶液反应的是_____________。
溶液反应的是_____________。
II. 现有一瓶浓度为 的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取
的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取 该酸
该酸 溶液,逐滴加入
溶液,逐滴加入 的氢氧化钠溶液,恰好反应完全时所需碱液体积为
的氢氧化钠溶液,恰好反应完全时所需碱液体积为 ,请用化学用语回答:
,请用化学用语回答:
(1)该酸不可能是____________;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为____________,用离子方程式说明溶液呈碱性的原因_________ _______________。
_______________。
III. A、B、C、D均为可溶于水的固体,组成它们的离子有:
| 阳离子 |  、 、 、 、 、 、 |
| 阴离子 |  、 、 、 、 、 、 |
 如下:
如下:①A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会消失。
②C与D反应有红褐色沉淀生成并放出气体。
③B与C反应有白色沉淀生成并放出气体。
(1)写出它们的化学式:A___________,B___________,C___________,D___________。
(2)写出③中B与C反应的离子方程式_________________________________。 查看习题详情和答案>>
①
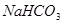 ;②
;②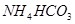 ;③
;③ ;④HF;⑤
;④HF;⑤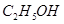 ;⑥
;⑥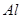 ;⑦食盐水;⑧
;⑦食盐水;⑧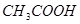
其中属于强电解质的是_____________(填序号,下同),既能跟盐酸反应又能跟
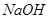 溶液反应的是_____________。
溶液反应的是_____________。II. 现有一瓶浓度为
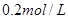 的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取
的某酸溶液,可能为醋酸、盐酸、硫酸中的一种,为了确定该酸溶液的组成进行实验:取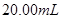 该酸
该酸 溶液,逐滴加入
溶液,逐滴加入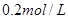 的氢氧化钠溶液,恰好反应完全时所需碱液体积为
的氢氧化钠溶液,恰好反应完全时所需碱液体积为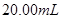 ,请用化学用语回答:
,请用化学用语回答:(1)该酸不可能是____________;
(2)用pH试纸测得反应后所得溶液呈碱性,根据此现象说明该酸溶液为____________,用离子方程式说明溶液呈碱性的原因_________
 _______________。
_______________。III. A、B、C、D均为可溶于水的固体,组成它们的离子有:
| 阳离子 | 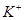 、 、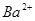 、 、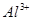 、 、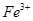 |
| 阴离子 | 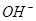 、 、 、 、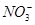 、 、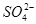 |
 如下:
如下:①A与B反应生成白色沉淀,再加过量A,沉淀量减少,但不会消失。
②C与D反应有红褐色沉淀生成并放出气体。
③B与C反应有白色沉淀生成并放出气体。
(1)写出它们的化学式:A___________,B___________,C___________,D___________。
(2)写出③中B与C反应的离子方程式_________________________________。
铜是人类最早生产和使用的金属之一,在化学反应中铜元素可表现为0、+1、+2价。
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
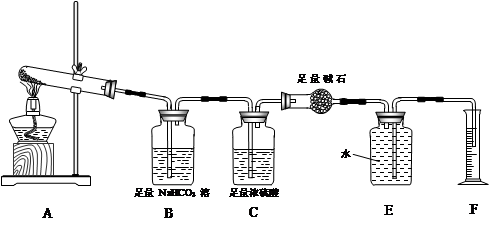
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
【设计实验】按如图装置进行试验。
|
 【实验过程】
【实验过程】a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO。
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g。
(3)装置C的作用 。
(4)根据装置E、F中现象,推测还有气体 (填分子式)生成;实验生成的SO3为 mol。(5)装置A中反应的化学方程式为 。
【实验结论】无水硫酸铜受热分解不仅仅生成CuO和SO3。
【反思与评价】
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素是 (任写2点)。 查看习题详情和答案>>
Ⅰ.(1)在西汉古籍中曾有记载:“曾青得铁则化为铜”,即:曾青(CuSO4)跟铁反应生成铜,试写出该反应的离子方程式 。
(2)在原电池和电解池中,铜常用作电极,下列有关说法正确的是
| A.锌铜原电池中铜是正极 | B.用电解法精炼铜时粗铜作阴极 |
| C.在镀件上镀铜时铜与电源正极相连 | D.铜作阳极时不一定溶解 |
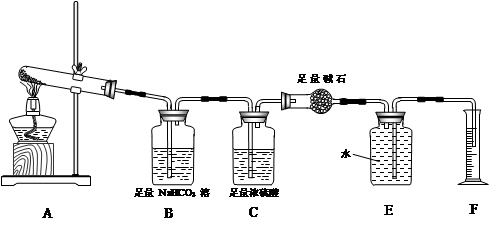
【提出问题】碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
【设计实验】按如图装置进行试验。
|
 【实验过程】
【实验过程】a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO。
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g。
(3)装置C的作用 。
(4)根据装置E、F中现象,推测还有气体 (填分子式)生成;实验生成的SO3为 mol。(5)装置A中反应的化学方程式为 。
【实验结论】无水硫酸铜受热分解不仅仅生成CuO和SO3。
【反思与评价】
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素是 (任写2点)。
(16分) 下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语
回答下列问题:
(1)④、⑤、⑥的原子半径由大到小的顺序为_______________________,②、⑦、⑧的最高价含氧酸的酸性由强到弱的顺序是______________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)_________________。
a.MnO2 b.FeCl 3 c.Na2SO3 d.KMnO4
若已知1 克该液态化合物分解成③的单质和一种常见液体时,可放出2.9kJ能量,写出该反应的热化学方程式:
(3)工业上常采用电解A和冰晶石(Na3AlF6)混合物的方法冶炼制备⑥的单质,请从A晶体的类型和微粒间的相互作用力角度解释加冰晶石(Na3AlF6)的原因 。 并写出电解时的电极反应式: 。
(4)甲、乙、丙是上述部分元素组成的双原子分子或负二价双原子阴离子,且甲、乙、丙的电子总数相等。甲是一种极强的氧化性单质。丙与⑤的阳离子可形成一种淡黄色固体B,该固体跟水反应可得到③的单质。则B电子式 ,乙的结构式 ,甲的组成元素的原子结构示意图 ,能证明甲的组成元素非金属性很强的事实 。(任举一例即可)
查看习题详情和答案>>