摘要:10.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 :Fe2++2H++H2O2== Fe3++2H2O 碳酸钙与盐酸反应 CaCO3+2H+== Ca2++CO2↑ +H2O
网址:http://m.1010jiajiao.com/timu3_id_52413[举报]
用硫酸处理铁悄所得到的溶液A中除Fe2+外,还含有一定量的Fe3+、Cu2+和Mn2+.今用A溶液制取硫酸亚铁晶体,并测定该晶体中结晶水的含量,实验方案如下:
实验1:制取硫酸亚铁晶体的过程如下图:
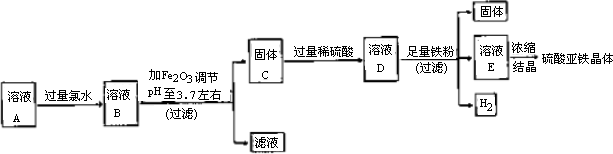
(1)往溶液A中加过量氯水的作用是________.
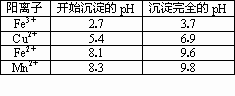
(2)右表是使一些金属离子转化为氢氧化物沉淀的pH,根据表中数据分析,固体C是________.
(3)有人提出,在处理溶液B时,先加入几滴石蕊试液,然后逐滴加入NaOH溶液至溶液恰好由红色变为紫色(pH约为5),过滤即可得到固体C,你认为此方案是否可行?________(填“行”或“不行”),其理由是________.
实验2:用下图装置进行测定硫酸亚铁晶体(FeSO4·nH2O)中结晶水含量的实验(图中半透膜可让气体通过又可防止固体粉末进入导管):将m1 g晶体置于C装置的硬质玻璃管中,加热至完全失去结晶水,冷却至常温后,称量玻璃管中固体的质量为m2 g.
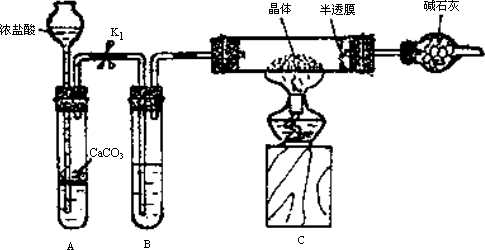
(1)B中的试剂是________.
(2)实验中有以下步骤:
①打开K1
②关闭K1
③点燃酒精灯
④熄灭酒精灯火焰,使C中玻璃管冷却至常温.
正确的实验操作顺序是________(填以上选项序号).
(3)根据实验结果,计算硫酸亚铁晶体中结晶水的n值为________.
(摩尔质量:FeSO4为152 g·mol-1;H2O为18 g·mol-1)
硫酸亚铁晶体(FeSO4?7H2O)在医药上作补血剂.某课外小组测定该补血剂中铁元素的含量.实验步骤如下:

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加
(2)步骤②加入过量H2O2的目的:
(3)步骤④中一系列处理的操作步骤:过滤、
(4)若实验无损耗,则每片补血剂含铁元素的质量
(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③将
(6)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,Fe3+
查看习题详情和答案>>

请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加
H2O2或氯水
H2O2或氯水
,该过程的现象为:滴加KSCN溶液不变色,再滴加H2O2(或氯水)后,溶液变红色
滴加KSCN溶液不变色,再滴加H2O2(或氯水)后,溶液变红色
.(2)步骤②加入过量H2O2的目的:
将Fe2+氧化成Fe3+
将Fe2+氧化成Fe3+
.(3)步骤④中一系列处理的操作步骤:过滤、
洗涤
洗涤
、灼烧、冷却、称量.(4)若实验无损耗,则每片补血剂含铁元素的质量
0.07a
0.07a
g.(5)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需
250mL容量瓶
250mL容量瓶
.②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是
b
b
.a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③将
酸式滴定管
酸式滴定管
(填仪器名称)中的酸性KMnO4逐滴滴入锥形瓶,终点时的现象描述为滴入一滴KMnO4溶液,恰好变为紫红色,且半分钟内不褪色
滴入一滴KMnO4溶液,恰好变为紫红色,且半分钟内不褪色
.(6)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36.室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH=3时,Fe3+
否
否
是、否)沉淀完全.硫酸亚铁铵[(NH4)2SO4?FeSO4?6H2O]为浅绿色晶体,实验室中常以废铁屑为原料来制备,其步骤如下:
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2:向处理过的铁屑中加入过量的3mol?L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有
①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研体 ⑥玻璃棒 ⑦酒精灯
(2)在步骤1中用碳酸钠溶液除去油污的化学原理是
(3)在步骤2中所加的硫酸必须过量,其原因是
(4)在步骤3中,“一系列操作”依次为
(5)本实验制备的硫酸亚铁铵晶体常含有杂质Fe3+.检验Fe3+常用的试剂是
查看习题详情和答案>>
步骤1:将废铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑.
步骤2:向处理过的铁屑中加入过量的3mol?L-1 H2SO4溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液.
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体.
请回答下列问题:
(1)在步骤1的操作中,下列仪器中不必用到的有
②④⑤
②④⑤
(填仪器编号)①铁架台 ②燃烧匙 ③锥形瓶 ④广口瓶 ⑤研体 ⑥玻璃棒 ⑦酒精灯
(2)在步骤1中用碳酸钠溶液除去油污的化学原理是
碳酸钠水解显碱性,油脂在碱性条件下水解生成可溶性的高级脂肪酸钠和甘油
碳酸钠水解显碱性,油脂在碱性条件下水解生成可溶性的高级脂肪酸钠和甘油
;(3)在步骤2中所加的硫酸必须过量,其原因是
抑制Fe2+水解
抑制Fe2+水解
;(4)在步骤3中,“一系列操作”依次为
蒸发浓缩
蒸发浓缩
、冷却结晶
冷却结晶
和过滤;(5)本实验制备的硫酸亚铁铵晶体常含有杂质Fe3+.检验Fe3+常用的试剂是
KSCN溶液
KSCN溶液
,可以观察到得现象是溶液出现血红色
溶液出现血红色
.草酸亚铁用作分析试剂及显影剂等,其制备流程如图甲:
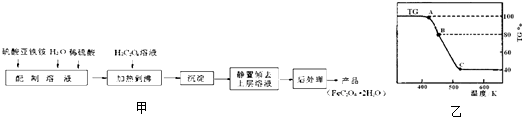
(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
查看习题详情和答案>>

(1)配制(NH4)2Fe(SO4)2?6H2O溶液时,需加少量稀硫酸,目的是
抑制Fe2+水解
抑制Fe2+水解
.(2)将制得的产品在氩气气氛中进行热重分析,结果如图乙(TG%表示残留固体质量占原样品总质量的百分数,Fe(SO4)2?2H2O的式量为180).
①A→B发生反应的化学方程式为
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
| ||
FeC2O4.2H2O(s)
FeC2O4(s)+2H2O(g)
.C处时残留物的化学式为
| ||
FeO
FeO
.②有研究学者在实验过程中用气相色谱还检出H2,最终产物中也有微量的磁性物质生成,请你猜想用一个方程式解释这种事实:
3FeO+H2O
Fe3O4+H2
| ||
3FeO+H2O
Fe3O4+H2
.
| ||
③现取在真空中146℃脱水后的FeC2O41.44g放在某真空的密闭容器中,再充入0.04molCO.加热至1100℃,其中FeO(s)+CO(g)?Fe(s)+CO2(g)反应平衡常数K=0.4,则该反应达平衡时,FeO的转化率为多少?
71.4%
71.4%
.硫酸铝是一个被广泛运用的工业试剂,可作为絮凝剂,用于提纯饮用水及污水处理设备当中,还可用于造纸工业等.硫酸铝中含铁量的大小直接影响造纸工业的产品质量.由铝土矿(氧化铝、氧化铁、氧化亚铁及二氧化硅等)制得成品无水硫酸铝工艺流程如下图所示:
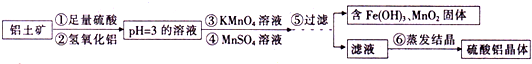
(1)第②步加入氢氧化铝的目的是 .
(2)第③步加入KMnO4溶液,可将二价铁离子氧化为三价铁离子,本身被还原为Mn2+,C( Mn2+)随时
间变化的隧线如图所示,分析曲线的变化趋势,
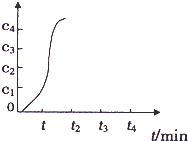
你认为形成该变化的原因是 .
(3)第④步加入MnSO4溶液,可与过量的KMnO4溶液反应生成活性二氧化锰,进而吸附三价铁离子水解生成的氢氧化铁,达到除铁的效果.请完成下列离子反应方程式:
Mn2++ MnO4-+ = MnO2↓+
(4)第⑥步蒸发操作必需的仪器有铁架台(含铁圈)、 、 、 .
查看习题详情和答案>>

(1)第②步加入氢氧化铝的目的是
(2)第③步加入KMnO4溶液,可将二价铁离子氧化为三价铁离子,本身被还原为Mn2+,C( Mn2+)随时
间变化的隧线如图所示,分析曲线的变化趋势,

你认为形成该变化的原因是
(3)第④步加入MnSO4溶液,可与过量的KMnO4溶液反应生成活性二氧化锰,进而吸附三价铁离子水解生成的氢氧化铁,达到除铁的效果.请完成下列离子反应方程式:
(4)第⑥步蒸发操作必需的仪器有铁架台(含铁圈)、