摘要:7.nmolN2和nmol14CO相比较.下列叙述中正确的是 ( ) A. 在同温同压下体积相等 B. 在同温同压下密度相等 C. 在标准状况下质量相等 D. 分子数相等
网址:http://m.1010jiajiao.com/timu3_id_52330[举报]
(2009?潍坊统考)已知五种短周期元素在周期表中的相对位置如下表所示:
(1)上述元素中离子半径最大的是
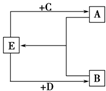 (2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成.它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:
(2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成.它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:
①A、B、E所含的该金属元素的原子结构示意图为
 ;
;
②若将D逐滴滴入A的溶液中至过量,反应过程中的离子方程式依次为
查看习题详情和答案>>
| a | |||||
| b | |||||
| c | d | e |
S
S
(填元素符号). (2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成.它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:
(2)已知A、B、C、D、E五种化合物均由上述元素中的几种组成.它们之间的转换关系如图所示,且A、B、E三种物质含有相同的一种金属元素,C和D分别是常见的强酸和强碱,则:①A、B、E所含的该金属元素的原子结构示意图为


②若将D逐滴滴入A的溶液中至过量,反应过程中的离子方程式依次为
Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-
Al3++3OH-═Al(OH)3↓,Al(OH)3+OH-═[Al(OH)4]-
.实现“节能减排”和“低碳经济”的一项重要课题就是 如何将CO2转化为可利用的资源.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下发生反应: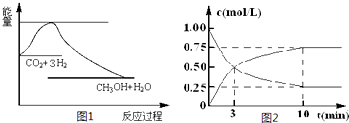
CO2(g)+3H2(g)═CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ?mol-1)的变化:
(1)关于该反应的下列说法中,正确的是
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
②该反应的平衡常数表达式K=
③下列措施中能使化学平衡向正反应方向移动的是
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
查看习题详情和答案>>

CO2(g)+3H2(g)═CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ?mol-1)的变化:
(1)关于该反应的下列说法中,正确的是
C
C
(填字母).A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示.
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=
0.075mol
0.075mol
mol?(L?min)-1;H2的转化率=75%
75%
②该反应的平衡常数表达式K=
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
③下列措施中能使化学平衡向正反应方向移动的是
BD
BD
(填字母).A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出表示CH3OH燃烧热的热化学方程式:
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ?mol-1
| 3 |
| 2 |
CH3OH(l)+
O2(g)=CO2(g)+2H2O(l)△H=-726.6 kJ?mol-1
.| 3 |
| 2 |
