摘要:工业制Al
网址:http://m.1010jiajiao.com/timu3_id_52219[举报]
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2?6H2O晶体,其工艺流程如图为:
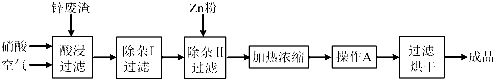
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为
(4)加入Zn粉的作用是
查看习题详情和答案>>

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
适当升高反应温度
适当升高反应温度
.(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
.(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4
5.2~5.4
.检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全
静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全
.(4)加入Zn粉的作用是
除去溶液中的Cu2+
除去溶液中的Cu2+
.“操作A”的名称是冷却结晶
冷却结晶
.工业上用铝土矿(主要成分为Al2O3,还有少量的Fe2O3,SiO2等杂质)提取氧化铝作冶炼铝的原料,提取的操作过程如下:
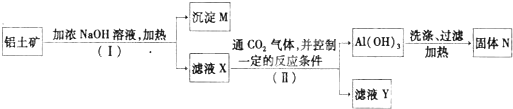
(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:
(2)沉淀M中除含有泥沙外,一定还含有
(3)滤液X中,含铝元素的溶质的化学式为
(4)实验室里常往AICl3溶液中加入
查看习题详情和答案>>

(1)Ⅰ和Ⅱ步骤中分离溶液和沉淀的操作是:
过滤
过滤
过滤
过滤
(2)沉淀M中除含有泥沙外,一定还含有
Fe2O3
Fe2O3
,固体N是Al2O3
Al2O3
;(3)滤液X中,含铝元素的溶质的化学式为
NaAlO2
NaAlO2
,它属于盐
盐
(填“酸”、“碱”或“盐”)类物质;写出Ⅰ过程所发生反应的化学方程式Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O
Al2O3+2NaOH=2NaAlO2+H2O、SiO2+2NaOH=Na2SiO3+H2O
;(4)实验室里常往AICl3溶液中加入
氨水
氨水
(填“氨水”或“NaOH溶液”)来制取A1(OH)3,写出该反应的化学方程式3NH3?H2O+AlCl3=Al(OH)3+3NH4Cl
3NH3?H2O+AlCl3=Al(OH)3+3NH4Cl
.工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
请回答下列问题:
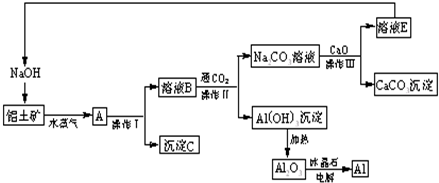
(1)操作I、操作II、操作III都是
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有
(3)写出Na2CO3溶液与CaO反应离子方程式:
(4)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:
查看习题详情和答案>>
请回答下列问题:

(1)操作I、操作II、操作III都是
过滤
过滤
(填操作名称),实验室要洗涤Al(OH)3沉淀应该在过滤器
过滤器
装置中进行.(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有
CaO和CO2
CaO和CO2
(填化学式).用此法制取铝得到的副产品是Fe2O3和O2
Fe2O3和O2
(填化学式).(3)写出Na2CO3溶液与CaO反应离子方程式:
CO32-+CaO+H2O═CaCO3↓+2OH-
CO32-+CaO+H2O═CaCO3↓+2OH-
.(4)若铝土矿中还含有二氧化硅,此生产过程中得到的氧化铝将混有杂质:
SiO2
SiO2
(填化学式).工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下:
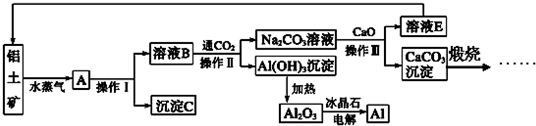
请回答下列问题:
(1)沉淀C的化学式为
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是
(4)电解熔融的氧化铝时,若得到标准状况下22.4L O2,则同时生成铝的质量为
(5)写出Na2CO3溶液与CaO反应的离子方程式:
查看习题详情和答案>>

请回答下列问题:
(1)沉淀C的化学式为
Fe2O3
Fe2O3
,该物质用途除了用于金属冶炼以外,还可用作颜料
颜料
.(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有
CaO和CO2
CaO和CO2
(填化学式).用此法制取铝的副产品是Fe2O3和O2
Fe2O3和O2
(填化学式).(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是
过滤
过滤
(填操作名称),实验室要洗涤Al(OH)3沉淀应该在过滤
过滤
装置中进行,洗涤方法是向漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次
向漏斗中加蒸馏水至浸没沉淀,使水自然流完,重复操作2~3次
.(4)电解熔融的氧化铝时,若得到标准状况下22.4L O2,则同时生成铝的质量为
36g
36g
.(5)写出Na2CO3溶液与CaO反应的离子方程式:
CO32-+CaO+H2O═CaCO3↓+2OH-
CO32-+CaO+H2O═CaCO3↓+2OH-
.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2?6H2O晶体,其工艺流程为:
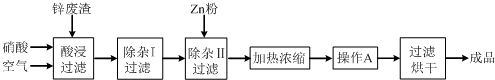
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措是
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为
(4)加入Zn粉的作用是
(5)在0.10mol?L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当pH=8时,溶液的c(Cu2+)浓度为
查看习题详情和答案>>

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
适当升高反应温度
适当升高反应温度
.(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
烧杯、玻璃棒、漏斗
烧杯、玻璃棒、漏斗
.(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O
2Fe2++H2O2+2H+=2Fe3++2H2O
.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4
5.2~5.4
.检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全
静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全
.(4)加入Zn粉的作用是
除去溶液中的Cu2+
除去溶液中的Cu2+
.“操作A”的名称是冷却结晶
冷却结晶
.(5)在0.10mol?L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当pH=8时,溶液的c(Cu2+)浓度为
2.2×10-8
2.2×10-8
(Ksp[Cu(OH)2]=2.2×10-20).