网址:http://m.1010jiajiao.com/timu3_id_51958[举报]
一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
2CO(g)+SO2(g)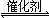 2CO2(g)+S(l)
△H
2CO2(g)+S(l)
△H
(1)已知2CO(g)+O2(g)= 2CO2(g) △H1=—566kJ•mol—1
S(l) +O2(g)= SO2(g) △H2=—296kJ•mol—1
则反应热ΔH= kJ•mol-1。
(2)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。260℃时 (填Fe2O3、NiO或Cr2O3)作催化剂反应速率最快。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑价格因素,选择Fe2O3的主要优点是 。

(3)科研小组在380℃、Fe2O3作催化剂时,研究了不同投料比[n(CO)∶n(SO2)]对 SO2转化率的影响,结果如图b。请在答题卡坐标图中画出n(CO)∶n(SO2)=2∶1 时,SO2转化率的预期变化曲线。
(4)工业上还可用Na2SO3溶液吸收烟气中的SO2:Na2SO3+SO2+H2O=2NaHSO3。某温度下用1.0mol•L-1 Na2SO3溶液吸收纯净的SO2,当溶液中c(SO32-)降至 0.2mol•L-1时,吸收能力显著下降,应更换吸收剂。
①此时溶液中c(HSO3-)约为______mol•L-1;
②此时溶液pH=______。(已知该温度下SO32—+H+ HSO3—的平衡常数K=8.0 × 106 L•mol-1,计算时SO2、H2SO3的浓度忽略不计)
HSO3—的平衡常数K=8.0 × 106 L•mol-1,计算时SO2、H2SO3的浓度忽略不计)
查看习题详情和答案>>
2CO(g)+O2(g)═2CO2(g)△H=-566kJ?mol-1
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1
由1mol CO(g)和3mol CH4(g)组成的混合气体在上述条件下充分燃烧,恢复至室温释放的热量为( )
2CO(g)+O2(g)=2CO2(g);△H=-566kJ?mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890kJ?mol-1
由等物质的量的CO和CH4的混合气体共3mol,在上述条件下完全燃烧时释放的热量为( )
在一定条件下,CO和CH4燃烧的热化学方程式分别为
2CO(g)+O2(g) 2CO2(g); △H=-566kJ·mol-1
CH4(g)+2O2(g) CO2(g)+2H2O(1); △H=-890kJ·mol-1
又知由H2与O2反应生成液态H2O 比生成气态H2O 多放出44kJ/mol的热量。则CH4 气体在空气中不完全燃烧热化学方程式正确的是
A.2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(1) △H=-1214kJ·mol-1
B.2CH4(g)+O2(g) CO2(g)+CO(g)+4H2O(g) △H=-1038kJ·mol-1
C.3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(1) △H=-1538kJ·mol-1
D.3CH4(g)+5O2(g) CO2(g)+2CO(g)+6H2O(g) △H=-1840kJ·mol-1