网址:http://m.1010jiajiao.com/timu3_id_51863[举报]
(1)在常温下,碳酸和次氯酸的电离常数如下表所示。

(2)甲醇是目前推广车用燃料,该物质可用天然气(主要成分为CH4)合成。
2CH4(g)+O2(g)=2CO(g)+4H2(g) △H1=-71kJ/mol①
CO(g)+2H2(g)=CH3OH(l) △H2=-90.5 kJ/mol②
CH4(g)+O2(g)=CH3OH(l) △H3=_____kJ/mol。
表示该反应过程中的能量变化的曲线是____(选填如图中的序号“I~Ⅳ”)。

a.硫酸沸点高,属于非挥发性酸
b.硫酸具有氧化性
c.稀硫酸与碳酸钙反应生成微溶的CaSO4
d.稀硫酸与碳酸钙反应不能持续地产生二氧化碳
(4)燃料电池所用燃料为可燃性气体,例如以CO为燃料就可以制作原电池,这种电池的一个电极中通入O2,另一个电极中通入CO,电解质采用的是熔融碳酸盐,由此可知该燃料电池放电时的负极反应式为________,如果使用该电池电解饱和食盐水制取NaClO,那么理论上生成1mol NaClO需要标准状况下的氧气的体积为____L。
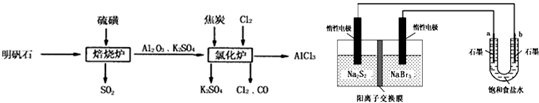
(1)焙烧炉中产生的SO2直接排放到空气中会形成酸雨,若某地酸雨的pH为4.6,在空气中放置一段时间后,pH变为4.0,其原因为
(2)氯化炉中发生的主要反应为:2Al2O3(s)+6Cl2(g)?4AlCl3(g)+3O2(g)△H>0.反应达平衡时,加焦炭能使平衡向正反应方向移动,理由是
(3)生产氯化铝的过程中会产生SO2、Cl2等大气污染物,若将二者按照一定比例通入水中可减少或消除污染.试设计简单实验检验二者是否恰好完全反应.(简要描述实验步骤、现象和结论)
仪器自选,可供选择试剂如下:
①滴加酚酞的氢氧化钠溶液 ②氯化亚铁溶液 ③硫氰化钾溶液 ④品红溶液
(4)工业上利用如下装置制备氯气:已知左侧原电池的工作原理为:2Na2S2+NaBr3
| ||
①用惰性电极电解饱和食盐水的化学方程式为
| ||
| ||
②如图所示原电池放电时,电池中的Na+向
③该原电池工作一段时间后,测得左槽中Na+物质的量由a mol变为b mol,则电解池中b电极上得到的气体在标准状况下的体积为
化学方程式练习
一、用化学方程式表示下列各种物质的实验室制法
1、O2(三种方法):
2、H2:
3、Cl2:
4、NH3:
5、CO2:
6、NO:
二、用方程式表示工业生产过程(参考选修Ⅱ,带*的写离子方程式,注意反应条件)
1、氯碱工业(电解饱和食盐水)
*阳极:
*阴极:
*总反应:
2、接触法制硫酸(硫铁矿为原料)
①沸腾炉: ;其中氧化产物为:
②接触室: ;
V2O5的作用是 ,反应温度控制在400~500℃的原因是
③吸收塔:
用98%H2SO4吸收SO3而不用水直接吸收的原因是
。
④尾气处理:
3、海水提溴:
*①氯化:
②吹出
③吸收:
④转化:
4、合成氨:
①由水和碳合成H2
②合成塔:
5、氨氧化制硝酸
①氧化炉:
②吸收塔:
③制取化肥硝酸铵:
6、冶炼铝(冰晶石作熔剂)
①碱溶:
②沉淀:
③脱水:
④电解:*阳极:
*阴极:
总反应:
7、铝热法制铁
8、由三氧化钨制钨
9、工业制漂白粉
10、制玻璃
11、工业生产石灰浆
12、联合制碱法:
13、高纯硅的生产
。
14、炼铁炼钢
①还原剂的生成:
;
②铁的还原(将铁的氧化物,如Fe2O3还原):
③将生铁脱硫去磷降低含碳量即得钢。
三、完成下列反应的化学方程式(注意写反应条件)。
1、Fe + H2O(g)=
2、C+ H2O(g) =
3、CO+ H2O(g) =
4、F2+ H2O=
5、NH3+H2O
6、NO2+ H2O=
7、SO2+ H2O
8、Cl2 + H2O=
9、K + H2O=
10、Na2O2+ H2O=
11、CaC2+ H2O=
12、Mg3N2+ H2O =
13、Al + NaOH+ H2O=
14、CaCO3+ H2O+ CO2=
15、Fe(OH)2+ H2O+ O2=
16、FeCl3+ H2O
17、NH4Cl+H2O
18、Na2CO3+H2O
19、CuSO4+H2O电解
20、Na2S2O3 + HCl =
21、SiO2 + HF=
22、SiO2 + NaOH=
23、Na2SiO3+ HCl=
四、写出下列物质分别与NaOH溶液反应的化学方程式。
1、Si
2、Cl2
3、SiO2
4、SO2 (足量)
5、CO2(小量)
6、H3PO4
7、H2SO4
8、CH3Br
9、Al
10、Al2O3
11、AlCl3
12、Al(OH)3
13、CuSO4
14、NaHCO3
15、Ca(HCO3)2(足量)
16、(NH4)2SO4
五、写出下列物质受热或光照的化学方程式。
1、NaHCO3
2、HNO3
3、AgBr
4、H2SO3
5、NH4HCO3
6、Cu(OH)2
7、Ca(HCO3)2
8、Cu2(OH)2CO3
9、H2O2
10、KClO3
11、KMnO4
12、NH4Cl
13、HClO
14、CH4+Cl2
15、H2+Cl2
16、CuO
六、写出下列反应的化学方程式和离子方程式
1、SO2使溴水褪色:
2、SO2使酸性高锰酸钾溶液褪色:
3、氢氧化铁溶于氢碘酸:
4、乙二酸(草酸)使酸性高锰酸钾溶液褪色 :
5、用石灰水与小苏打溶液制烧碱:
6、硫酸氢铵与氢氧化钡溶液混合:
7、漂白粉溶液中充入足量CO2:
8、KHSO4与氢氧化钡溶液混合呈中性:
9、Fe3O4溶于稀硝酸:
10、明矾溶液中加Ba(OH)2溶液至沉淀量最大:
七、用离子方程式表示下列在溶液中的反应
1、KCl+AgNO3:
2、Ba(OH)2+H2SO4:
3、BaCO3+HCl:
4、Cu(OH)2+HCl:
5、Fe(OH)2+HNO3(稀) :
6、FeCl3+KSCN:
7、FeBr2+Cl2(物质的量之比为1:1):
8、NaBr+Cl2:
9、Fe+CuCl2:
10、Zn+AgNO3:
11、纯碱水解:
12、明矾净水:
13、铜和稀硝酸:
14、配制银氨溶液:
15、Na2O2投入稀硫酸中:
八、写出下列物质在空气中变质的化学方程式
1、Na2SO3:
2、NaOH:
3、NO:
4、Na:
5、Na2O2:
6、铜生锈:
7、氯水:
8、白磷:
9、稀硫酸酸化的FeSO4溶液变棕黄色
10、无色KI溶液变棕黄色
11、漂白粉失效:
九、写出下列反应的化学方程式
1、混合H2S和SO2生成硫和水:
2、炭加热放入浓硫酸中:
3、乙醇催化氧化为乙醛:
4、乙醛与银氨溶液反应:
5、乙醛与新制Cu(OH)2加热:
6、铜与浓硫酸共热:
7、氧化硫通入浓溴水:
8、铜与浓硝酸反应:
9、木炭和浓硝酸共热:
10、FeCl3溶液中加入KI溶液:
11、高锰酸钾固体中滴入浓盐酸:
12、氨水通入少量SO2:
13、偏铝酸钠溶液中加足量稀硫酸:
14、NaAlO2溶液中充入足量CO2:
15、Ba(AlO2)2溶液中加入硫酸铝溶液:
16、氢氧化亚铁水溶液在空气中变质:
12、氯化铁溶液溶解铜:
十、按要求写方程式
1、写出高温条件下发生的置换反应四个:
①
②
③
④
2、写出一个点燃条件下的置换反应:
3、写出一个加热条件下的置换反应:
4、写出一个有三种反应物的置换反应:
5、写出工业生产中需要高温条件的反应(不少于5个)的化学方程式:
6、试设计一个实验,检验某溶液中存在Fe2+,请在下面的横线上按操作顺序写出相应的离子方程式: 。
7、治疗胃酸过多的药物中常用Al(OH)3,如何用氧化铝制取氢氧化铝?要求制取过程中酸碱的用量降到最少。按生产顺序写出相关的离子方程式: 。
8、化学反应中有的具有相似性,有的反应具有特殊性,试写出下列相关化学方程式,并思考其中的原因:
① Li + O2
Na + O2
② Mg + CO2
Mg + SO2
③ Na2O2 + CO2
Na2O2 + SO2
KO2 + CO2
④ F2 + H2O
Cl2 + H2O
⑤ Fe + Cl2
Fe + I2
⑥ Fe(OH)3 + HCl
Fe(OH)3 + HI
9、按要求写化学方程式
①碱性氧化物与水反应(举2例)
②碱性氧化物与酸反应(举2例)
③金属氧化物但不是碱性氧化物的氧化物与水反应(举一例)
④酸性氧化物与水反应(举2例,其中一例为金属氧化物)
⑤能与水反应生成酸,但不是酸性氧化物也不是碱性氧化物氧化物与水反应的化学方程式:
。
⑥列举不少于5类既能与强酸反应,又能与强碱反应的物质,并分别写出它们与酸(HCl)、碱(NaOH)反应的离子方程式:
A、物质化学式:
B、物质化学式:
C、物质化学式:
D、物质化学式:
E、物质化学式:
F、物质化学式:
G、物质化学式:
10、某酸性氧化物,它能与某些酸反应,也能与碱反应,请写出这样的氧化物一种,并写出它与酸反应的化学方程式和与碱反应的离子方程式:
氧化物分子式:
查看习题详情和答案>>