摘要: A 解析 金属的活动性Zn>Cu>Ag,合金属于混合物,地壳中含量最多的元素是氧元素.含量最多的金属元素是铝元素.
网址:http://m.1010jiajiao.com/timu3_id_5182[举报]
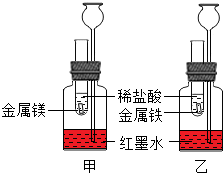 金属是一类重要的材料,研究其性质十分必要.
金属是一类重要的材料,研究其性质十分必要.(1)地壳中含量最多的金属元素是
铝
铝
.(2)人们对铝的利用比铜和铁晚.金属大规模开发和利用的先后顺序主要与
A
A
(填序号)有关.A.金属的活动性 B.金属的导电性 C.金属的导热性
(3)下面是某小组同学对金属镁和铁性质的对比研究.
①在室温条件下进行如图所示实验.试管内的镁和铁表面均被打磨过,且形状、大小均相同,向两支试管中同时加入相同质量的稀盐酸.
可观察到单位时间内产生气泡多的是
镁
镁
(填“镁”或“铁”),可得出的结论是:金属活动性Mg
Mg
>Fe
Fe
(填元素符号).②已知化学反应一般伴随着能量变化,因此,还可以观察到反应在相同时间内,两支长颈漏斗内的液面高度不同,长颈漏斗内液面上升高的是
镁
镁
(填“镁”或“铁”,下同),由此可得出的结论是:在单位时间内,等质量的镁、铁分别与等质量的盐酸反应放出的热量多的是镁
镁
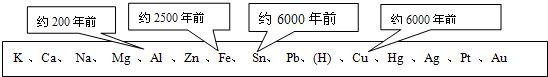
.化学的研究目的就是帮助人们认识、改造和应用物质,把金属矿物冶炼成金属就是人们利用化学方法实现物质改造的典型范例.下表中不同的金属被开发和利用的年代不同,从化学反应的角度看,决定这一年代先后顺序的关键因素是( )

查看习题详情和答案>>
(2012?宁夏)铝、铁、铜是我们生活中常见的金属.
(1)铝的利用比铜、铁晚是因为金属大规模开发和利用的先后顺序与
A.金属的活动性 B.金属的导电性 C.金属在底壳中的含量
(2)铝具有很好的抗腐蚀性能,原因是
(3)每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟
(4)印发铜制电路板的“腐蚀性”为FeCl3溶液反应,化学方程式分别为①Cu+2FeCl3=2FeCl3+CuCl3;②Fe+2FeCl3=3X.则②中X的化学式为
查看习题详情和答案>>
(1)铝的利用比铜、铁晚是因为金属大规模开发和利用的先后顺序与
A
A
有关(填字母)A.金属的活动性 B.金属的导电性 C.金属在底壳中的含量
(2)铝具有很好的抗腐蚀性能,原因是
铝与氧气反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
铝与氧气反应,在其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步被氧化
(3)每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟
氧气
氧气
和水
水
共同作用的结果;防止铁生锈的方法是刷漆
刷漆
(写一种);焊接铁制品时,通常先用稀盐酸除去其表面的铁锈,反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+6HCl=2FeCl3+3H2O
;(4)印发铜制电路板的“腐蚀性”为FeCl3溶液反应,化学方程式分别为①Cu+2FeCl3=2FeCl3+CuCl3;②Fe+2FeCl3=3X.则②中X的化学式为
FeCl2
FeCl2
.铝、铁、铜是我们生活中常见的金属.
(1)铝的利用比铜、铁晚是因为金属大规模开发和利用的先后顺序与
A.金属的活动性 B.金属的导电性 C.金属在底壳中的含量
(2)铝具有很好的抗腐蚀性能,原因是
(3)化学新材料的应用,使人们的生活质量不断提高.如图是不同年代常用的水管.
①图示所有水管中,含有的金属元素是
②每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟
③铁丝在空气中不能燃烧却在氧气中剧烈燃烧,其燃烧的化学方程式为
(4)印发铜制电路板的“腐蚀性”为FeCl3溶液反应,化学方程式分别为①Cu+2FeCl3═2FeCl2+CuCl2;②Fe+2FeCl3═3X.则②中X的化学式为
查看习题详情和答案>>
(1)铝的利用比铜、铁晚是因为金属大规模开发和利用的先后顺序与
A
A
有关(填字母)A.金属的活动性 B.金属的导电性 C.金属在底壳中的含量
(2)铝具有很好的抗腐蚀性能,原因是
铝表面有一层致密的氧化铝保护膜,从而阻止铝进一步被氧化
铝表面有一层致密的氧化铝保护膜,从而阻止铝进一步被氧化
.(3)化学新材料的应用,使人们的生活质量不断提高.如图是不同年代常用的水管.

①图示所有水管中,含有的金属元素是
Fe、Zn
Fe、Zn
.②每年全世界钢铁的产量很高,但钢铁的锈蚀也给人类带来了巨大的损失,铁在空气中锈蚀,实际上是铁跟
氧气( 或空气)和水
氧气( 或空气)和水
共同作用的结果;工业上常用稀盐酸来除铁锈(Fe203),该反应的化学方程式是6HCl+Fe2O 3=2FeCl3+3 H2O
6HCl+Fe2O 3=2FeCl3+3 H2O
.请你提出一种防止铁制品锈蚀的方法:在铁制品表面涂漆
在铁制品表面涂漆
.③铁丝在空气中不能燃烧却在氧气中剧烈燃烧,其燃烧的化学方程式为
3Fe+2O2
Fe3O4
| ||
3Fe+2O2
Fe3O4
.
| ||
(4)印发铜制电路板的“腐蚀性”为FeCl3溶液反应,化学方程式分别为①Cu+2FeCl3═2FeCl2+CuCl2;②Fe+2FeCl3═3X.则②中X的化学式为
FeCl2
FeCl2
.请根据下表信息回答:
说明:导电性以银的导电性为100作标准,硬度以金刚石的硬度为10作标准.
(1)菜刀用铁做而不用铝做的主要原因是:
(2)表中导电性最强的金属是
(3)铝表面能形成薄膜的化学方程式
(4)金属大规模开发和利用的先后顺序与下列
A.金属的活动性
B.金属冶炼的难易程度
C.金属在地壳中的含量.
查看习题详情和答案>>
| 金属 | 熔点/℃ | 导电性 | 硬度 | 化学性质 | 冶炼的大致年限 |
| Al | 660 | 61 | 2~2.9 | 常温下与氧气反应,表面形成致密的薄膜 | 约200年前 |
| Fe | 1535 | 17 | 4~5 | 在潮湿的空气中易生锈 | 约3000年前 |
| Cu | 1083 | 99 | 2.5~3 | 在高温时与氧气反应 | 约6000年前 |
(1)菜刀用铁做而不用铝做的主要原因是:
铁的硬度比铝大
铁的硬度比铝大
.(2)表中导电性最强的金属是
铜
铜
.(3)铝表面能形成薄膜的化学方程式
4Al+3O2═2Al2O3
4Al+3O2═2Al2O3
.(4)金属大规模开发和利用的先后顺序与下列
AB
AB
有关.A.金属的活动性
B.金属冶炼的难易程度
C.金属在地壳中的含量.