题目内容
(2013?普陀区二模)用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率.工业上用化学气相沉积法制备氮化硅,反应如下:3SiCl4+2N2+6H2
Si3N4+12HCl
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于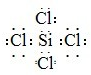
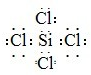 .
.
(2)比较Si和Cl两种元素非金属性强弱的方法是
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较两种元素的原子达到稳定结构获得电子的多少
d.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为
| 高温 |
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于
原子
原子
晶体.有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是H、Cl
H、Cl
(填写元素符号);属于非极性分子的化合物的电子式是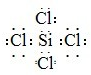
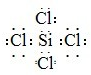
(2)比较Si和Cl两种元素非金属性强弱的方法是
b
b
.a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较两种元素的原子达到稳定结构获得电子的多少
d.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为
它们都在元素周期表中金属和非金属的分界线附近
它们都在元素周期表中金属和非金属的分界线附近
(简述理由),写出Si与强碱溶液反应的离子反应方程式:Si+2OH-+H2O=SiO32-+2H2↑
Si+2OH-+H2O=SiO32-+2H2↑
.分析:(1)氮化硅制造发动机的耐热部件,熔点很高,属于原子晶体;
根据核外电子排布规律书写外围电子排布式,据此判断;
SiCl4是非极性分子化合物,分子中Si原子与Cl原子之间形成1对共用电子对;
(2)a.物理性质不能不能比较元素的非金属性;
b.得到1个电子放出能量越多,表明该原子得到电子后越稳定,即越容易得到电子;
c.非金属性强弱与与得电子多少无关,与得电子难易程度有关;
d.应比较最高价含氧酸的酸性强弱;
(3)Si与Al、Be都在元素周期表中金属和非金属的分界线附近,具有相似的化学性质;
Si与强碱溶液反应生成硅酸盐与氢气.
根据核外电子排布规律书写外围电子排布式,据此判断;
SiCl4是非极性分子化合物,分子中Si原子与Cl原子之间形成1对共用电子对;
(2)a.物理性质不能不能比较元素的非金属性;
b.得到1个电子放出能量越多,表明该原子得到电子后越稳定,即越容易得到电子;
c.非金属性强弱与与得电子多少无关,与得电子难易程度有关;
d.应比较最高价含氧酸的酸性强弱;
(3)Si与Al、Be都在元素周期表中金属和非金属的分界线附近,具有相似的化学性质;
Si与强碱溶液反应生成硅酸盐与氢气.
解答:解:(1)氮化硅制造发动机的耐热部件,熔点很高,属于原子晶体,
H、N、Si、Cl的外围电子排布式分别为1s1、2s22p3、3s23p2、3s23p5、故H、Cl原子最外层只有一个未成对电子,
SiCl4是非极性分子化合物,分子中Si原子与Cl原子之间形成1对共用电子对,电子式为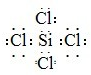 ,
,
故答案为:原子;H、Cl;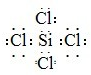 ;
;
(2)a.气态氢化物的沸点为物理性质,不能说明非金属性强弱,故a错误;
b.得到1个电子放出能量越多,表明该原子得到电子后越稳定,即越容易得到电子,非金属性越强,故b正确;
非金属性越强,氢化物越稳定性,故氢化物稳定性可以说明中心元素的非金属性强弱,故正确;
c.非金属性强弱与得电子多少无关,与得电子难易程度有关,如S原子得2个电子形成硫离子,Cl原子得1个电子形成硫离子,但硫元素非金属性强,故c错误;
d.氢化物酸性强弱不能比较非金属性,若非金属性F>Cl,但HF是弱酸,HCl是强酸,故d错误;
故答案为:b;
(3)Si与Al、Be都在元素周期表中金属和非金属的分界线附近,具有相似的化学性质;
Si与强碱溶液反应生成硅酸盐与氢气,反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,
故答案为:它们都在元素周期表中金属和非金属的分界线附近;Si+2OH-+H2O=SiO32-+2H2↑.
H、N、Si、Cl的外围电子排布式分别为1s1、2s22p3、3s23p2、3s23p5、故H、Cl原子最外层只有一个未成对电子,
SiCl4是非极性分子化合物,分子中Si原子与Cl原子之间形成1对共用电子对,电子式为
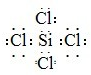 ,
,故答案为:原子;H、Cl;
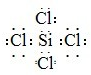 ;
;(2)a.气态氢化物的沸点为物理性质,不能说明非金属性强弱,故a错误;
b.得到1个电子放出能量越多,表明该原子得到电子后越稳定,即越容易得到电子,非金属性越强,故b正确;
非金属性越强,氢化物越稳定性,故氢化物稳定性可以说明中心元素的非金属性强弱,故正确;
c.非金属性强弱与得电子多少无关,与得电子难易程度有关,如S原子得2个电子形成硫离子,Cl原子得1个电子形成硫离子,但硫元素非金属性强,故c错误;
d.氢化物酸性强弱不能比较非金属性,若非金属性F>Cl,但HF是弱酸,HCl是强酸,故d错误;
故答案为:b;
(3)Si与Al、Be都在元素周期表中金属和非金属的分界线附近,具有相似的化学性质;
Si与强碱溶液反应生成硅酸盐与氢气,反应离子方程式为:Si+2OH-+H2O=SiO32-+2H2↑,
故答案为:它们都在元素周期表中金属和非金属的分界线附近;Si+2OH-+H2O=SiO32-+2H2↑.
点评:本题考查晶体结构与性质、常用化学用语、核外电子排布、结构位置性质关系、元素周期律等,难度中等,掌握基础知识即可解答,注意掌握非金属性强弱比较方法.

练习册系列答案
相关题目