网址:http://m.1010jiajiao.com/timu3_id_51281[举报]
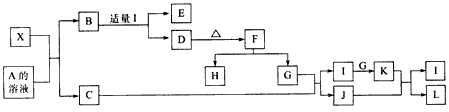
回答以下问题:
(1)写出X的化学式:_______________。
(2)写出X与A溶液反应的化学方程式:_____________写出K与J反应的化学方程式_____________。
(3)X与SiC的复合粉末是新一代大规模集成电路的理想散热材料。最近日本科学家研究出一种新物质与氮气制备该纳米级复合材料的方法,请将该反应补充完整(横线上填新物质的化学式):
_______+2N2
 4X+SiC+3C。
4X+SiC+3C。 I.氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是 。
a.N2可用于填充霓虹灯,其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道时以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是 。
向硫酸铜溶液中先加过量氨水,后加适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体,
该晶体中不含有的化学键是 。
| A.极性键 | B.非极性键 | C.离子键 | D.配位键 E.氢键 |
(3)目前市售的发光二极管,其材质以砷化镓(GaAs) 为主。已知镓是与铝同族,镓的基态原子的电子排布式是 。GaAs中Ga的化合价为 。
(4)金属钛坚硬、强度大、耐热、密度小,被称为高技术金属。TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟, 则TiCl4属于 (填“原子”“分子”或“离子”)晶体。
(5) 钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种的化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,产生白色沉淀; 往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时, 产生淡黄色沉淀,则第二种配合物的化学式为 。
 [化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.
[化学--选修物质结构与性质]目前,我省多地正在积极推广使用太阳能.常见的太阳能电池有单晶硅太阳能电池、多 晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等.(1)Cu+在基态时的价电子排布式为
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ?mol-1)大于硒(941kJ?mol-1).请从原子结构的角度加以解释
(3)As2O3俗名砒霜,是一种剧毒物质.法医检验砒霜中毒的方法是:向试样中加入锌粉和盐酸,如果有砒霜,将生成无色气体AsH3,将气体导入热玻璃管会分解成亮黑色的“砷 镜”,这就是著名的“马氏验砷法”.请用化学方程式表示检验原理:
(4)硼酸(H3BO3)在水溶液中易结合一个OH-生成[B(OH)4]-,而体现弱酸性.
①[B(OH)4]-中B原子的杂化类型为
②[B(OH)4]-的结构式为
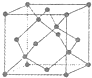
(5)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原 子交替,即得到碳化硅晶体(金刚砂).
①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是
②立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm.立方氮化硼晶胞中含有
(1)有下列五种物质:①钠 ②白磷 ③苛性钠溶液 ④氯水 ⑤硝酸银溶液,其中应保存在棕色瓶中的是______,应保存在煤油中的是______,应保存在水中的是______,应用带胶塞的试剂瓶盛放的是______(填入相应的序号)
(2)新制备的氯水显黄绿色,说明氯水中有Cl2分子存在.蓝色石蕊试纸遇到氯水后,首先变红,但很快又褪色,这是因为______.氯水经光照后,黄绿色逐渐消失,并放出无色气体,有关反应的化学方程式是:
______
(3)NO是大气污染物之一.目前,有一种治理方法是在400℃左右,有催化剂存在的情况下,用氨把NO还原为氮气和水,请写出反应的化学方程式______.
查看习题详情和答案>>
(20分)A物质是实验室一种无色有毒的挥发性液体,由X、Y两种短周期元素组成。A在空气中极易着火生成B气体和C气体;A不溶于水,但加热到423K可以和水反应,生成B气体和D气体,D只含两种元素,其中一种是Y。在交流放电的情况下,分解生成E气体、F固体两种物质,E物质和B化学式量几乎相等,含Y元素约72.7%;F是环状单质分子,具有冠状结构,易溶于A,F的式量约是C的4倍。E可在液氮条件下与HBr于77K生成含双键结构的物质G,冷却至室温可得G的环状三聚体H。
6-1 写出A、B、C、D、E、F、G、H的结构简式。
6-2 用X射线衍射法测得F的晶体为正交晶系,晶胞参数a=1048pm,b=1292pm,c=2455pm。已知该物质的密度为2.07g?cm-3。计算每个晶胞中F分子的数目。
6-3 自发现富勒烯以来,其神奇的结构和性能引起了人们对碳原子团簇广泛和深入的研究。除了碳原子团簇之外,其它元素的原子团簇是否也具有类似碳原子团簇的奇异的特性,这是个十分有趣的研究课题。F物质有很多同分异构体,在实验手段受到各种条件的限制时,理论研究是一种重要的补充。厦门大学化学系对F物质的原子团簇进行了理论计算,发现除了冠状结构外还有多种结构。其中一种X具有2次对称轴,以及两个包含对称轴的对称面,一配位和三配位原子数目相等;另外一种Y是一种椅式结构原子团簇增加2个原子形成,也具有二次对称轴,对称面和对称轴垂直。请画出这两种结构的原子团簇。
6-4 五氟化砷AsF5(2.93g)和上述物质F(0.37g)用四氮化四硫S4N4(0.53g)在液态SO2溶剂中发生完全的反应,溶剂和挥发性产物被泵抽出后得黄色固体残留物L(3.08g),分析J知其含有:As 28.04%,F 42.70%,N 5.25%,经分析L是离子化合物,阴离子为正八面体结构,阳离子为两种元素组成,结构是直线形。固体L(0.48g)溶于液态二氧化硫,和叠氮化铯Cs+N3-(0.31g)完全反应,收集应释放出得氮气于66.5kPa、298K为67.1cm3。反应混合物过滤得难溶蓝黑色纤维状固体J(0.16g)。分析J知其含有2种元素,其中含N 30.3%。红外光谱、X射线粉末衍射结果表明抽出SO2后残留物是六氟砷(V)酸铯。
(1)L的实验式是什么?
(2)提出L的结构式;
(3)写出配平的生成L的方程式;
(4)1mol L发生转化时生成氮气的物质的量;
(5)J的化学式;
(6)写出n mol L生成J的普遍离子方程式。
查看习题详情和答案>>