摘要:1.氮族元素的原子结构与性质 (1)周期表中的位置: 第VA族 (2)原子结构: 相同点:最外层电子数相同(5e-) 不同点:电子层数不同.原子半半径依次增大 (3)主要性质: ①相似性:a.最高价态为+5.负价为-3.能形成氢化物RH3.Sb.Bi无负价,最高价氧化对应水化物HRO3或H3RO4 呈酸性. ②递变性::a.原子半径由小到大,b.氢化物的稳定性由强到弱,c.最高价含氧酸的酸性由强到弱,d.非金属性由强到弱.且比同周期卤族元素.氧族元素弱.金属性渐强.
网址:http://m.1010jiajiao.com/timu3_id_51280[举报]
|
根据磷元素的原子结构示意图所示,做出如下推理,其中与事实不符的是
| |
| [ ] | |
A. |
磷元素位于元素周期表的第三周期、第VA族 |
B. |
磷原子不如氮原子和硫原子的得电子能力强 |
C. |
磷单质不如氮气和硫单质的化学性质活泼 |
D. |
磷的氢化物(PH3)受热时不如氮的氢化物(NH3)和硫的氢化物(H2S)稳定 |
|
根据磷元素的原子结构示意图 | |
| [ ] | |
A. |
磷元素位于元素周期表的第三周期、第VA族 |
B. |
磷原子不如氮原子和硫原子的得电子能力强 |
C. |
磷单质不如氮气和硫单质的化学性质活泼 |
D. |
磷的氢化物(PH3)受热时不如氮的氢化物(NH3)和硫的氢化物(H2S)稳定 |
不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方.
下面是某些短周期元素的x值;
(1)通过分析x值变化规律,确定N、Mg的x值范围;
(2)推测x值与原子半径的关系是
(3)某有机化合物结构式为C6H5-S-NH2,其中S-N中,你认为共用电子对偏向谁?
(4)经验规律告诉我们:设成键的两原子相应元素的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般共价键,试推断AlBr3中化学键类型是
(5)预测元素周期表中,x值最小的元素位置:
查看习题详情和答案>>
下面是某些短周期元素的x值;
| 元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
| x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
0.93
0.93
<x(Mg)<1.57
1.57
,2.55
2.55
<x(N)<3.44
3.44
.(2)推测x值与原子半径的关系是
同周期(同主族)中,x值越大,其原子半径越小
同周期(同主族)中,x值越大,其原子半径越小
;根据短周期元素x值变化特点,体现了元素性质的周期性
周期性
变化规律.(3)某有机化合物结构式为C6H5-S-NH2,其中S-N中,你认为共用电子对偏向谁?
氮原子
氮原子
(写原子名称).(4)经验规律告诉我们:设成键的两原子相应元素的差值(△x),当△x>1.7时,一般为离子键,当△x<1.7时,一般共价键,试推断AlBr3中化学键类型是
共价键
共价键
.(5)预测元素周期表中,x值最小的元素位置:
第六周期IA族
第六周期IA族
(放射性元素除外).【物质结构与性质】
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:
(1)镓为元素周期表第31号元素,镓原子价层电子排布图为___________。
(2)氮所在主族中第一电离能最大的元素是________(填元素符号,下同),镓所在主族中电负性最大的元素是____________________。
(3)传统的氮化镓制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式为______________。
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以____相结合,氮化镓属于_______晶体。
(5)下图是氮化镓的晶胞模型:
①氮化镓中镓原子的杂化方式为__________,氮原子的配位数为___________。
②氮化镓为立方晶胞,氮化镓的密度为d g/cm3。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
【物质结构与性质】
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:
(1)镓为元素周期表第31号元素,镓原子价层电子排布图为___________。
(2)氮所在主族中第一电离能最大的元素是________(填元素符号,下同),镓所在主族中电负性最大的元素是____________________。
(3)传统的氮化镓制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式为______________。
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以____相结合,氮化镓属于_______晶体。
(5)下图是氮化镓的晶胞模型:

①氮化镓中镓原子的杂化方式为__________,氮原子的配位数为___________。
②氮化镓为立方晶胞,氮化镓的密度为d g/cm3。列出计算氮化镓晶胞边长a的表达式:a=_______cm。
以氮化镓(GaN)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点。回答下列问题:
(1)镓为元素周期表第31号元素,镓原子价层电子排布图为___________。
(2)氮所在主族中第一电离能最大的元素是________(填元素符号,下同),镓所在主族中电负性最大的元素是____________________。
(3)传统的氮化镓制备方法是采用GaCl3与NH3在一定条件下反应,该反应的化学方程式为______________。
(4)氮化镓与金刚石具有相似的晶体结构,氮化镓中氮原子与镓原子之间以____相结合,氮化镓属于_______晶体。
(5)下图是氮化镓的晶胞模型:

①氮化镓中镓原子的杂化方式为__________,氮原子的配位数为___________。
②氮化镓为立方晶胞,氮化镓的密度为d g/cm3。列出计算氮化镓晶胞边长a的表达式:a=_______cm。

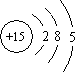 ,做出如下推理,其中与事实不符的是
,做出如下推理,其中与事实不符的是