网址:http://m.1010jiajiao.com/timu3_id_51126[举报]
(1)若A是常见金属,且A的合金用量最大,A与B的浓溶液在常温时发生钝化,但A与B的稀溶液反应产生无色气体并能迅速转化为红棕色.请写出过量的A与B的稀溶液反应的化学方程
(2)若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式
(3)若A为黑色固体,C是黄绿色的单质气体,反应的化学方程式为
若向100mL 12.0mol?L-1的B中加入足量的A固体并加热,充分反应后在标准状况下生成C的体积是
A.等于6.72L B.小于6.72L
C.等于13.44L D.大于6.72L小于13.44L
(4)已知炭和浓硫酸在加热时也符合上述反应式,某同学设计如下实验证明其产物:
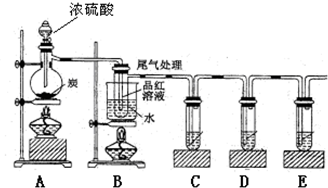
若证明有水生成,需要在A、B之间加装盛有
(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。 2CO2(g)+6H2(g)
 CH3CH2OH(g) +3H2O(g) △H=akJ.mol-1 在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g) +3H2O(g) △H=akJ.mol-1 在一定压强下,测得上述反应的实验数据如下表。 
①上述反应的a____________0(填“大于”或“小于”)。
②在一定温度下,提高氢碳比,则CO2转化率___________(填“增大”“减小” 或“不变”)。
(2)催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示

②在一定温度下,2 mol CO(g)和4 mol H2 (g)反应达到平衡时,生成b mol CH3CH2OH(g)和b mol H2O(g),若向上述密闭容器中加入4 mol CO、8 mol H2 及固体催化剂,使之反应。平衡时,反应产生的热量Q__________2E2(填“>”“<” 或“=”);生成CH3CH2OH的物质的量___________2b(填“>”“<”或“=”),你的判 断依据是________________。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效的优良性能。 以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,其工作原理 与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是________________。
(化学实验)饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.2005年的《化学教育》报道了如下实验研究:
实验一、定性研究:
①在试管中加入过量的块状碳酸钙,再加入约20 mL饱和氯水,充分反应,有少量气泡产生,溶液浅黄绿色褪去;
②过滤,将滤液滴在有色布条上,发现其比氯水的漂白性更强;
③为了确定反应产物,将滤液分为三份,分别进行以下实验:
第一份与石灰水混合,立即产生大量白色沉淀;
第二份与稀盐酸混合,立即产生大量无色气体;
将第三份加热,看到溶液变浑浊且有大量无色气体产生.经检测,上述实验中产生的无色气体均为CO2.请回答:
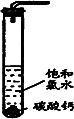
(1)反应后所得的溶液漂白性增强的原因是____________.
(2)依据上述实验可推知:②的滤液中的溶质除CaCl2、HClO外,还含有__________.
实验二、定量研究:
在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙和150 mL饱和氯水,按如图所示装置实验,待不再产生气泡后,将塑料网中剩余的石灰石提出液面,密封后再加热、煮沸烧瓶中的液体,直到量筒中的气体不再增加(不考虑HClO的分解).请回答:
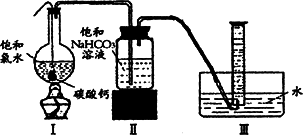
(3)为减少用装置Ⅲ收集气体过程中CO2因溶解而造成的损失,且水槽中仍然为水,请你对装置Ⅲ进行改进,最简单的方法是____________.
(4)用改进后的装置进行上述实验,测得塑料网内的碳酸钙质量减少Ag,总共收集到标准状况下的CO2气体BL,发现B/22.4 moL明显小于A/100 moL.若不考虑实验操作和CO2的溶解等因素造成的误差,从化学反应原理来看,导致这一大小关系的原因是____________.
(5)实验后发现,装置Ⅱ中的液体增多了,其原因是________.
某化学研究小组测定某FeCl3 样品(含少量FeCl2 杂质)中铁元素的质量分数,在实验室中按以下步骤进行实验:
① 称取a g样品,置于烧杯中;
② 加适量盐酸和适量蒸馏水使样品溶解,准确配制成250mL溶液;
③ 准确量取25.00 mL步骤②中配得的溶液,置于烧杯中,加入适量的氯水,使反应完全;
④ 加入过量氨水,充分搅拌,使沉淀完全;
⑤ 过滤,洗涤沉淀;
⑥ 将沉淀转移到坩埚内,加热、搅拌,直到固体由红褐色全部变为红棕色后,冷却至室温后,称量;
⑦……。
请根据上面叙述,回答:
(1)上图仪器中,实验步骤①②③中必须用到的仪器是E和 (填仪器序号);
(2)检验沉淀是否洗净,应向洗涤液中加入几滴 (填写序号);
①KSCN溶液 ②NaOH溶液 ③AgNO3 溶液 ④酚酞试液
(3)步骤③④中所发生变化的化学方程式为___________________________________________________________________
(4) 第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为m1g,再次加热并冷却至室温称量其质量为m2 g,若m1与m2 差值较大,假设称量时操作没有错误,则其原因可能是 (答出两点即可);
(5)若坩埚质量是W1 g,最终坩埚和固体的总质量是W2 g,则样品中铁元素的质量分数为 。
