题目内容
某些化学反应可表示为:A+B═C+D+H2O(未配平,条件略).请回答:
(1)若A是常见金属,且A的合金用量最大,A与B的浓溶液在常温时发生钝化,但A与B的稀溶液反应产生无色气体并能迅速转化为红棕色.请写出过量的A与B的稀溶液反应的化学方程 ,若要检验反应后的溶液中含有的金属阳离子,其方法是 (写出操作、现象和结论).
(2)若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式 .
(3)若A为黑色固体,C是黄绿色的单质气体,反应的化学方程式为 ;
若向100mL 12.0mol?L-1的B中加入足量的A固体并加热,充分反应后在标准状况下生成C的体积是 (填字母序号).
A.等于6.72L B.小于6.72L
C.等于13.44L D.大于6.72L小于13.44L
(4)已知炭和浓硫酸在加热时也符合上述反应式,某同学设计如下实验证明其产物:
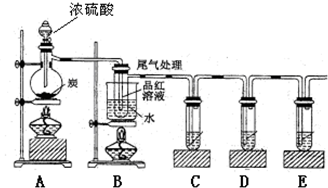
若证明有水生成,需要在A、B之间加装盛有 (填化学式)固体的干燥管;若证明生成CO2,C、D、E试管中分别需要盛放的试剂是 、 、 ;装置B可以探究SO2与品红作用的可逆性,请写出实验操作及现象 .
(1)若A是常见金属,且A的合金用量最大,A与B的浓溶液在常温时发生钝化,但A与B的稀溶液反应产生无色气体并能迅速转化为红棕色.请写出过量的A与B的稀溶液反应的化学方程
(2)若A、D均可用于消毒,且C是家家户户的厨房必备的物质之一,写出该反应的离子方程式
(3)若A为黑色固体,C是黄绿色的单质气体,反应的化学方程式为
若向100mL 12.0mol?L-1的B中加入足量的A固体并加热,充分反应后在标准状况下生成C的体积是
A.等于6.72L B.小于6.72L
C.等于13.44L D.大于6.72L小于13.44L
(4)已知炭和浓硫酸在加热时也符合上述反应式,某同学设计如下实验证明其产物:

若证明有水生成,需要在A、B之间加装盛有
分析:(1)A是常见金属,且A的合金用量最大,则A是Fe,铁和B的浓溶液发生钝化现象,则B为浓硫酸或浓硝酸,铁和B的稀溶液生成无色气体,但无色气体能迅速转化为红棕色,则铁和B的稀溶液反应生成的气体是NO,B是HNO3,过量的铁和稀硝酸反应生成硝酸亚铁、一氧化氮和水,亚铁离子具有还原性,能被强氧化剂氧化生成铁离子,铁离子和硫氰化钾溶液反应生成血红色;
(2)若A和D均可用于消毒,且C是家家户户的厨房必备的物质之一,则该反应是氯气和氢氧化钠溶液的反应,A是Cl2、B是NaOH、C是NaCl、D是NaClO,据此写出离子反应方程式;
(3)A是黑色固体,C是黄绿色气体单质,则C是Cl2、A是MnO2,该反应是实验室制取氯气的反应,根据反应物、生成物和反应条件书写其反应方程式,当浓盐酸浓度达到一定程度后变为稀盐酸,稀盐酸和二氧化锰不反应;
(4)在加热条件下,浓硫酸和碳反应生成二氧化碳、二氧化碳和水,实验室常用无水硫酸铜检验水,用品红溶液检验二氧化硫,用酸性高锰酸钾溶液吸收二氧化硫,用澄清石灰水检验二氧化碳.
(2)若A和D均可用于消毒,且C是家家户户的厨房必备的物质之一,则该反应是氯气和氢氧化钠溶液的反应,A是Cl2、B是NaOH、C是NaCl、D是NaClO,据此写出离子反应方程式;
(3)A是黑色固体,C是黄绿色气体单质,则C是Cl2、A是MnO2,该反应是实验室制取氯气的反应,根据反应物、生成物和反应条件书写其反应方程式,当浓盐酸浓度达到一定程度后变为稀盐酸,稀盐酸和二氧化锰不反应;
(4)在加热条件下,浓硫酸和碳反应生成二氧化碳、二氧化碳和水,实验室常用无水硫酸铜检验水,用品红溶液检验二氧化硫,用酸性高锰酸钾溶液吸收二氧化硫,用澄清石灰水检验二氧化碳.
解答:解:(1)A是常见金属,且A的合金用量最大,则A是Fe,铁和B的浓溶液发生钝化现象,则B为浓硫酸或浓硝酸,铁和B的稀溶液生成无色气体,但无色气体能迅速转化为红棕色,则铁和B的稀溶液反应生成的气体是NO,B是HNO3,过量的铁和稀硝酸反应生成硝酸亚铁、一氧化氮和水,反应方程式为:3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O;
亚铁离子具有还原性,能被强氧化剂氧化生成铁离子,铁离子和硫氰化钾溶液反应生成血红色,则检验亚铁离子的方法为:取反应后的溶液适量于试管中,加入KSCN溶液,无明显变化,滴入新制的氯水,溶液变为红色,说明含有亚铁离子,
故答案为:3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O;取反应后的溶液适量于试管中,加入KSCN溶液,无明显变化,滴入新制的氯水,溶液变为红色,说明含有亚铁离子;
(2)若A和D均可用于消毒,且C是家家户户的厨房必备的物质之一,则该反应是氯气和氢氧化钠溶液的反应,A是Cl2、B是NaOH、C是NaCl、D是NaClO,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)A是黑色固体,C是黄绿色气体单质,则C是Cl2、A是MnO2,该反应是实验室制取氯气的反应,反应方程式为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,当浓盐酸浓度达到一定程度后变为稀盐酸,稀盐酸和二氧化锰不反应,所以生成的氯气体积小于6.72L,
故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;B;
(4)在加热条件下,浓硫酸和碳反应生成二氧化碳、二氧化碳和水,实验室常用无水硫酸铜检验水,水能使无水硫酸铜变蓝色;
用品红溶液检验二氧化硫,用酸性高锰酸钾溶液吸收二氧化硫,用澄清石灰水检验二氧化碳,所以C是酸性高锰酸钾溶液、D是品红溶液、E是澄清石灰水,二氧化硫能和有色物质反应生成无色物质,无色物质不稳定,在加热条件下,易分解而使溶液恢复为红色,
故答案为:CuSO4;酸性高锰酸钾溶液、品红溶液、澄清石灰水;装置B中品红溶液褪色后关闭分液漏斗的活塞,点燃酒精灯加热烧杯,溶液恢复为红色.
亚铁离子具有还原性,能被强氧化剂氧化生成铁离子,铁离子和硫氰化钾溶液反应生成血红色,则检验亚铁离子的方法为:取反应后的溶液适量于试管中,加入KSCN溶液,无明显变化,滴入新制的氯水,溶液变为红色,说明含有亚铁离子,
故答案为:3Fe+8HNO3=3Fe(NO3)3+2NO↑+4H2O;取反应后的溶液适量于试管中,加入KSCN溶液,无明显变化,滴入新制的氯水,溶液变为红色,说明含有亚铁离子;
(2)若A和D均可用于消毒,且C是家家户户的厨房必备的物质之一,则该反应是氯气和氢氧化钠溶液的反应,A是Cl2、B是NaOH、C是NaCl、D是NaClO,离子反应方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)A是黑色固体,C是黄绿色气体单质,则C是Cl2、A是MnO2,该反应是实验室制取氯气的反应,反应方程式为:MnO2+4HCl(浓)
| ||
故答案为:MnO2+4HCl(浓)
| ||
(4)在加热条件下,浓硫酸和碳反应生成二氧化碳、二氧化碳和水,实验室常用无水硫酸铜检验水,水能使无水硫酸铜变蓝色;
用品红溶液检验二氧化硫,用酸性高锰酸钾溶液吸收二氧化硫,用澄清石灰水检验二氧化碳,所以C是酸性高锰酸钾溶液、D是品红溶液、E是澄清石灰水,二氧化硫能和有色物质反应生成无色物质,无色物质不稳定,在加热条件下,易分解而使溶液恢复为红色,
故答案为:CuSO4;酸性高锰酸钾溶液、品红溶液、澄清石灰水;装置B中品红溶液褪色后关闭分液漏斗的活塞,点燃酒精灯加热烧杯,溶液恢复为红色.
点评:本题考查了无机物的推断,根据物质的颜色、特殊性质等特点来推断物质,同时考查学生分析问题、解决问题的能力,知道二氧化碳和二氧化硫性质的相同点和不同点,注意二氧化硫和二氧化碳都能使澄清石灰水变浑浊,为易错点.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目