网址:http://m.1010jiajiao.com/timu3_id_50503[举报]
实验证明:铜不能在常温下与O2反应,也不能与稀硫酸共热发生反应。但工业上可将废铜屑倒入热的稀硫酸中并通入空气,此时铜屑在此条件下逐渐被溶解,从而成功制得CuSO4。请回答下列问题。
(1)写出Cu制取CuSO4(稀H2SO4环境下)的方程式________________;
(2)Cu与浓H2SO4共热也能制取CuSO4,其反应方程式为:________________;以上两种制取方法________________者好(填“前”或“后”),原因是________________。
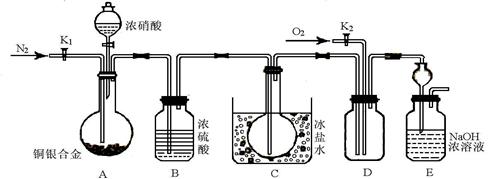
查看习题详情和答案>>(13分) 某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在”。为此,他们设计了如下图所示的装置。回答下列问题:
(1)写出A中Cu与HNO3反应可能的离子方程式 。
(2)实验前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3 既无挥发也无分解,则:①参加反应的HNO3的物质的量为 mol
②若已测出反应后E装置的生成物中含氮元素的质量m克,则为确定合金中Cu的质量分数还需测定的数据是 ,若测得该数据为n,写出合金中铜的质量(设为x克)的求算式子(只需列式子,不需解方程) 。
(5)为减小上述实验误差,在D中观察到实验现象后还须进行的操作是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。只利用A装置中反应后的溶液进行简单的操作,也可以确定合金中Cu的质量分数,其实验操作过程为
。
(13分) 某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在”。为此,他们设计了如下图所示的装置。回答下列问题:

(1)写出A中Cu与HNO3反应可能的离子方程式 。
(2)实验前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3 既无挥发也无分解,则:①参加反应的HNO3的物质的量为 mol
②若已测出反应后E装置的生成物中含氮元素的质量m克,则为确定合金中Cu的质量分数还需测定的数据是 ,若测得该数据为n,写出合金中铜的质量(设为x克)的求算式子(只需列式子,不需解方程) 。
(5)为减小上述实验误差,在D中观察到实验现象后还须进行的操作是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。只利用A装置中反应后的溶液进行简单的操作,也可以确定合金中Cu的质量分数,其实验操作过程为
。
查看习题详情和答案>>
(1)写出A中Cu与HNO3反应可能的离子方程式 。
(2)实验前先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 ;实验发现,通入的O2温度高低对实验现象有较大影响,为便于观察应通入(填“热”或“冷”) 的O2。
(4)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L-1;实验后A溶液:V=40mL c(H+)=1.0 mol·L-1。假设反应中HNO3 既无挥发也无分解,则:①参加反应的HNO3的物质的量为 mol
②若已测出反应后E装置的生成物中含氮元素的质量m克,则为确定合金中Cu的质量分数还需测定的数据是 ,若测得该数据为n,写出合金中铜的质量(设为x克)的求算式子(只需列式子,不需解方程) 。
(5)为减小上述实验误差,在D中观察到实验现象后还须进行的操作是 。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。只利用A装置中反应后的溶液进行简单的操作,也可以确定合金中Cu的质量分数,其实验操作过程为
。
Ⅰ.某学习小组对粗铜提纯(电解精炼)后的阳极泥(主要成分为银、金)进行如下实验.
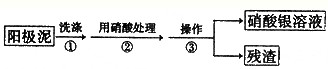
(1)操作③所需的仪器有:烧杯、
(2)为了回收金,他们查阅了有关资料如表:
| 编号 | 常温下反应 | 化学平衡常数 |
| 反应1 | Au+6HNO3 Au(NO3)3+3NO2↑+3H2O Au(NO3)3+3NO2↑+3H2O |
<10-5 |
| 反应2 | Au3++Cl-  [AuCl4]- [AuCl4]- |
>105 |
Ⅱ.学习小组对无水硫酸铜分解的产物进行实验探究.
[提出问题]碳酸钙受热分解生成CaO和CO2,那么无水硫酸铜受热分解也只生成CuO和SO3吗?
[设计实验]按如图装置进行试验.
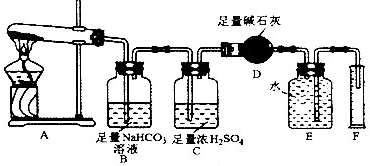
[实验过程]
a.准确称取无水硫酸铜2.40g于装置A试管中加热,直至固体全部变为黑色,经验证该黑色粉末为CuO
b.实验中,观察到装置E中的水部分被排入量筒中;实验结束后,测得量筒中水的体积为112mL(已折算成标准状态下气体的体积),并测得干燥管D的质量增加了1.32g.
(3)装置C的作用
(4)根据装置E、F中现象,推测还有气体
(5)装置A中反应的化学方程式为
| ||
| ||
[实验结论]无水硫酸铜受热分解不仅仅生成Cu和SO3.
[反思与评价]
(6)任何实验都存在误差,请指出本实验中可能造成误差的因素