题目内容
实验证明:铜不能在常温下与O2反应,也不能与稀硫酸共热发生反应。但工业上可将废铜屑倒入热的稀硫酸中并通入空气,此时铜屑在此条件下逐渐被溶解,从而成功制得CuSO4。请回答下列问题。
(1)写出Cu制取CuSO4(稀H2SO4环境下)的方程式________________;
(2)Cu与浓H2SO4共热也能制取CuSO4,其反应方程式为:________________;以上两种制取方法________________者好(填“前”或“后”),原因是________________。
(1)2H2SO4+O2+2Cu![]() 2CuSO4+2H2O
2CuSO4+2H2O
(2)2H2SO4(浓)+Cu![]() CuSO4+SO2↑+2H2O 前 节省硫酸用量,无污染物排放
CuSO4+SO2↑+2H2O 前 节省硫酸用量,无污染物排放
解析:
在加热条件下,Cu与O2作用转变为CuO,CuO可溶于稀H2SO4生成CuSO4和H2O。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案(1)无机非金属材料.单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿.其主要用途是用做半导体材料和利用太阳能光伏发电、供热等.单晶硅的制备方法如下:
SiO2
| ①C |
| 高温 |
| ②HCI |
| 300℃ |
| ③过量H2 |
| 1000~1100℃ |
①写出步骤①的化学方程式:
②已知以下几种物质的沸点:
| 物质 | SiHCl3 | SiCl4 | HCl |
| 沸点 | 33.0℃ | 57.6℃ | -84.7℃ |
(2)金属材料.金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称.包括纯金属、合金和特种金属材料等.
①下列物质中不属于合金的是
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈.试写出保护铜制品的方法:
(3)纳米材料,胶体粒子的直径大约是
(4)磁性材料.某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20g固体.
①该磁性粉末中氧元素的质量分数为
②该材料的化学式为
材料是科学技术进步的关键,是科学技术和社会发展的物质基础。材料的发展不仅影响了人类的昨天和今天,而且还将影响到人类的明天。请回答以下与材料有关的问题。
(1)无机非金属材料。单晶硅是一种比较活泼的非金属元素,是晶体材料的重要组成部分,处于新材料发展的前沿。其主要用途是用做半导体材料和利用太阳能光伏发电、供热等。单晶硅的制备方法如下:
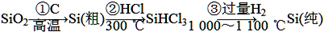
①写出步骤①的化学方程式:______________________。
②已知以下几种物质的沸点:
|
物质 |
SiHCl3 |
SiCl4 |
HCl |
|
沸点 |
33.0 ℃ |
57.6 ℃ |
-84.7 ℃ |
在步骤②中提纯SiHCl3所进行的主要操作的名称是________。
(2)金属材料。金属材料是指金属元素或以金属元素为主构成的具有金属特性的材料的统称。包括纯金属、合金和特种金属材料等。
①下列物质中不属于合金的是( )。
A.钢铁 B.青铜 C.硬铝 D.水银
②铜器制品常因接触空气中的O2、CO2和H2O而易生成铜锈。试写出保护铜制品的方法:___________________________________________________。
(3)纳米材料,胶体粒子的直径大约是________,与纳米材料的尺寸相当。实验室制取Fe(OH)3胶体溶液的方法是_________________________________,
用________方法消除胶体中的浑浊,根据________现象证明胶体已经制成。实验中必须要用蒸馏水,而不能用自来水,其原因是____________________。
(4)磁性材料。某磁性粉末材料是一种复合型氧化物,为测定其组成,现称取6.26 g样品,将其全部溶于过量稀HNO3,加入过量Na2SO4溶液,生成4.66 g白色沉淀、过滤、在滤液中加入过量NaOH溶液,生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20 g固体。①该磁性粉末中氧元素的质量分数为________;②该材料的化学式为________。
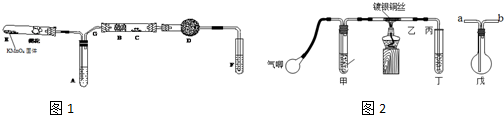
 (1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)
(1)实验过程中,一定能观察到的现象有:(所需空白数可根据需要增减)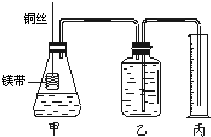 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为