摘要:7.一个原电池的某极反应式为:Fe – 2e- = Fe2+.该原电池材料及电解质溶液可能是 A B C D 正极 Fe Fe C Cu 负极 Cu Zn Fe Zn 电解质溶液 HCl CuSO4 CuSO4 FeSO4
网址:http://m.1010jiajiao.com/timu3_id_50269[举报]
一个原电池的某极反应式为:Fe-2e-=Fe2+,该原电池材料及电解质溶液可能是( )
查看习题详情和答案>>
| A | B | C | D | |
| 正极 | Fe | Fe | C | Cu |
| 负极 | Cu | Zn | Fe | Fe |
| 电解质溶液 | HCl | CuSO4 | CuSO4 | Fe2(SO4)3 |
| A.A | B.B | C.C | D.D |
一个原电池的某极反应式为:Fe-2e-=Fe2+,该原电池材料及电解质溶液可能是( )
A.A
B.B
C.C
D.D
查看习题详情和答案>>
| A | B | C | D | |
| 正极 | Fe | Fe | C | Cu |
| 负极 | Cu | Zn | Fe | Fe |
| 电解质溶液 | HCl | CuSO4 | CuSO4 | Fe2(SO4)3 |
A.A
B.B
C.C
D.D
查看习题详情和答案>>
(2010?海南模拟)一个原电池的某极反应式为:Fe-2e-=Fe2+,该原电池材料及电解质溶液可能是( )
|
查看习题详情和答案>>
如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
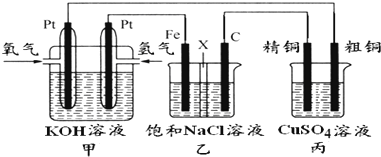
根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
(5)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为
查看习题详情和答案>>

根据要求回答相关问题:
(1)通入氧气的电极为
正极
正极
(填“正极”或“负极”),负极的电极反应式为H2-2e-+2OH-=2H2O
H2-2e-+2OH-=2H2O
.(2)铁电极为
阴极
阴极
(填“阳极”或“阴极”),石墨电极(C)的电极反应式为]2Cl--2e-=Cl2↑
2Cl--2e-=Cl2↑
.(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
减小
减小
(填“增大”“减小”或“不变”).(4)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
1.204×1023
1.204×1023
;丙装置中阴极析出铜的质量为12.8g
12.8g
.(5)若将乙装置中铁电极与石墨电极位置互换,其他装置不变,此时乙装置中发生的总反应式为
Fe+2H2O
Fe(OH)2↓+H2↑
| ||
Fe+2H2O
Fe(OH)2↓+H2↑
.
| ||
 某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:
某校化学研究性学习小组欲设计实验验证Fe、Cu的金属活动性,他们提出了以下两种方案.请你帮助他们完成有关实验项目:方案Ⅰ:有人提出将形状和大小均相等的铁片和铜片,分别同时放入100ml2.0mol/L稀硫酸中,观察产生气泡的快慢,据此可以确定它们的金属活动性.该原理的离子方程式为:
Fe+2H+═Fe2++H2↑;
Fe+2H+═Fe2++H2↑;
;若反应进行到2min时共收集到标准状况下的气体1120ml,则用硫酸表示的该反应的反应速率为(溶液体积变化忽略不计):0.25mol/(L?min)
0.25mol/(L?min)
.方案Ⅱ:有人利用Fe、Cu作电极设计成原电池,以确定它们的活动性.试在下面的方框内画出你设计的原电池装置图,注明电解质溶液名称和正负极材料,标出电子流动方向,并写出电极反应式.
正极反应式:
2H++2e-═H2↑
2H++2e-═H2↑
.负极反应式:
Fe-2e-═Fe2+
Fe-2e-═Fe2+
.方案Ⅲ:结合你所学的知识,帮助他们再设计一个验证Fe、Cu活动性的简单实验方案(与方案Ⅰ、Ⅱ不能雷同):
将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的
将铁片置于CuSO4溶液中,一段时间后观察Fe表面有红色的金属铜析出,即可以证明金属铁的活泼性强于金属铜的
,用离子方程式表示其反应原理:Fe+Cu2+═Fe2++Cu
Fe+Cu2+═Fe2++Cu
.