摘要:将两个铂电极插入氢氧化钾溶液中.向两极分别通入甲烷和氧气.即构成甲烷燃料电池.已知通入甲烷的一极.其电极反应为:CH4 + 10OH- - 8e- = CO32- + 7H2O,通入氧气的另一极.其电极反应式是2O2 + 4H2O +8e- = 8OH-.下列叙述正确的是 A.通入甲烷的电极为负极 B.燃料电池工作时.溶液中的阴离子向正极移动 C.正极发生氧化反应 D.该电池使用一段时间后应补充氢氧化钾
网址:http://m.1010jiajiao.com/timu3_id_49921[举报]
将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应为:CH4+10OH--8e-=CO32-+7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-=8OH-,下列叙述不正确的是( )
| A、通入甲烷的电极为负极 | B、燃料电池工作时,溶液中的阴离子向正极移动 | C、正极发生还原反应 | D、该电池使用一段时间后应补充氢氧化钾 |
将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池,已知通入甲烷的一极,其电极反应为CH4+10OH--8e-
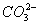 +7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e-
+7H2O;通入氧气的另一极,其电极反应式是2O2+4H2O+8e- 8OH-,下列叙述正确的是( )
8OH-,下列叙述正确的是( )
A.通入甲烷的电极为正极
B.正极发生氧化反应
C.该电池使用一段时间后应补充氢氧化钾
D.燃料电池工作时,溶液中的阴离子向正极移动
查看习题详情和答案>>
将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,即构成甲烷燃料电池。已知通入甲烷的一极,其电极反应式为CH4+10OH--8e-====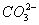 +7H2O,通入氧气的另一极,其电极反应式是:2O2+4H2O+8e-====8OH-。下列叙述正确的是( )
+7H2O,通入氧气的另一极,其电极反应式是:2O2+4H2O+8e-====8OH-。下列叙述正确的是( )
A.通入甲烷的电极为负极
B.正极发生氧化反应?
C.该电池使用一段时间后需补充氢氧化钾
D.燃料电池工作时,溶液中的阴离子向正极移动
查看习题详情和答案>>